常规的PCR技术只能对两端序列已知的DNA片段进行扩增,但在实际工作中常常需要通过基因上一小段已知序列对其邻近序列进行扩增。为了解决这一问题,科学家们对常规PCR进行技术改进,发明了多种获得已知基因两侧序列的方法,包括反向PCR、锚定PCR、RACE-cDNA末端的快速扩增等。本文主要对反向PCR做一介绍。反向PCR(inverse-PCR,IPCR)具有与常规PCR方向相反的引物,并且IPCR的扩增方向与普通PCR相反,因此称为反向PCR。
IPCR实验是将待扩增片段环化,通过一对方向相反的引物实现已知序列两侧基因序列的扩增(见下图)。常规PCR的方向是相对的,可以扩增一对引物之间的片段,因此想要扩增引物两侧的基因片段,需要设计方向相反的引物。但用方向相反的引物进行PCR扩增,是无法得到足够的产物的,因为每个引物只能对各自的模板线性扩增,无法进行指数级增长。为了解决这个问题,需对扩增的DNA模板先进行酶切,然后连接环化,使其引物方向成为相对,而后再进行PCR扩增。
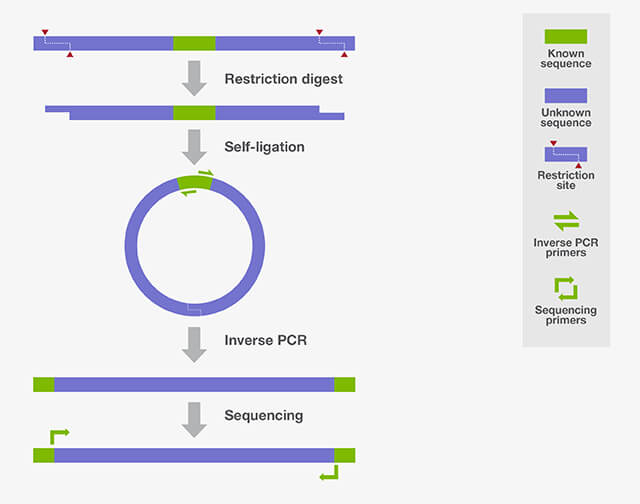
图1:反向PCR技术原理
引物的方向与常规PCR相反,其设计原则与常规PCR相同。
取基因组DNA,先用适宜的限制性酶进行切割,随后去除反应中的限制性酶,再用连接酶将酶切片段进行自身连接,形成一环状结构(为了提高IPCR效率,有时会将环化模板再次线性化会有利于扩增,即在已知序列的引物之间寻找一合适的酶切位点,且该位点在待研究的侧翼未知序列上不存在,用相应的限制性酶消化,即可获得线性化的模板)。
根据模板设置合适的条件进行PCR扩增。一般来说,在IPCR实验中只进行一轮PCR是不够的,通常会设计不同的引物进行两轮或两轮以上的PCR反应(巢式PCR)。
扩增产物可以通过琼脂糖凝胶电泳分析判断其分子量,也可以进行TA克隆并进行测序获得基因序列。
反转录PCR对克隆侧翼未知DNA序列快速有效,是常规PCR技术的重要补充,是分子生物学技术的重要方法之一。IPCR在分子生物学研究中应用广泛,可以检测病毒、转座子[1]等在基因组中的整合位点,克隆基因的邻接序列以及建立基因组步移[2]文库等。虽然该技术目前存在一定的缺陷(如基因组的复杂度、扩增的长度等有一定的限制),但随着分子生物学技术的发展,必将会得到不断的完善。
注释:
[1] 转座子:基因组中一段特异的具有转位特异性的独立DNA序列,可以从基因组中单独复制或断裂下来,环化后插入另一位点,并对其后的基因起调控作用。
[2] 基因组步移:通过一段已知序列探知其旁邻的序列,并将探得的序列作为已知序列进一步探知其旁邻序列的方法称为基因组步移。

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策