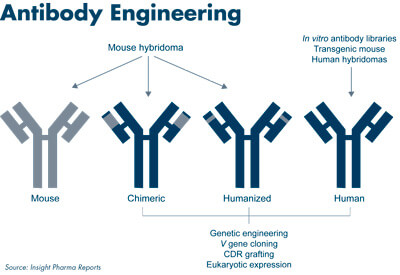
单克隆抗体的分类
以细胞融合为基础的鼠杂交瘤技术的发展,使得人们能够大量获取高亲和性和强特异性的
鼠单克隆抗体(McAb),McAb在理论和实践上的应用成为解决生物学和医学等许多重大问题的重要手段。但是鼠源性单抗应用于人类的临床应用结果反映出了单克隆抗体药物存在的一些问题 :
- 鼠源性单抗容易容易产生人抗鼠抗体(HAMA) ,在体内作为异源蛋白被清除掉,从而削弱其治疗的有效性。
- 鼠源性单抗在人体内生物活性降低,其Fc段不能有效激活人体FcRn及补体系统的效应功能。
- 鼠源性单抗在人体内的半衰期短,因而降低了其疗效。
因此,人们一直致力于人源性抗体的研究,鼠抗体人源化就是通过基因改造,使其和人体内的抗体分子具有极其相似的轮廓,从而逃避人免疫系统的识别,避免诱导HAMA(人抗鼠抗体)反应。进行抗体的人源化有两个基本原则:保持或提高抗体的亲和力和特异性;大大降低或基本消除抗体的免疫原性。人源化有多种方案,都必须遵循这两个原则,尤其不能丧失抗体特异结合的能力。
鼠源性单抗
人用鼠源单抗的生产方法一般分为体内法和体外法2种。
体内法:体内法即腹水法。尽管腹水中抗体浓度比较高(2-10mg/ml),但由于所用的BALB/c小鼠必须达到SPF级,繁殖、饲养BALB/c小鼠及生产腹水、纯化抗体的厂房必须符合GMP要求,WHO及我国对体内法生产的人用鼠源单克隆抗体的质检项目繁多,要求严格,因此限制了体内法在人用鼠源单抗生产领域的应用。
体外法:体外法(杂交瘤细胞体外培养法)的产品纯度高,可以避免鼠类病毒的污染,简化质检项目,操作具有可控制性,适用于大规模工业生产,因此是人用鼠源单抗生产方式的主要发展方向。体外法的制备流程也基本相同,即从超免疫的供体中即抗原免疫的小鼠获取脾细胞,选育出非分泌免疫球蛋白缺陷型的骨髓瘤细胞,待细胞融合后,对单个细胞进行克隆,体外培养出能分泌单抗的克隆细胞。
人鼠嵌合性单抗(Chimeric Antibody)
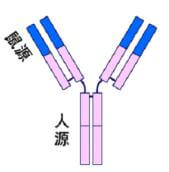
第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于异源性Ab的免疫反应约有90%是针对恒定区(C区),要降低mAb的抗原性,必须对Ab的恒定区进行人源化。构建嵌合抗体的大致原理是,从分泌某mAb的杂交瘤细胞基因组中分离和鉴别出重排的功能性可变区(V区)基因,经基因重组与Ig恒定区基因相拼接,插入到适宜的表达载体中,构成鼠/人嵌合的轻重链基因表达质粒,经转染骨髓瘤细胞,通过筛选即可制备出鼠/人嵌合抗体。这种嵌合抗体同鼠源抗体比较至少有以下两个优点:
- 它可以按需要对抗体的效应基因进行选择或剪切。例如人Ig的同种型IgG1和IgG3对介导补体依赖及细胞介导的溶解作用具备优势,因而利用该技术可以拼接不同亚类的人C区基因,来改变抗体的效应功能,使原细胞毒性较低的IgG2a和IgG2b变成细胞毒性较高的IgG1和IgG3,增强抗体的免疫治疗功能,可用来杀死肿瘤细胞。
- 在治疗中使用人而不是鼠mAb的同种型,减小了鼠源mAb作为异种蛋白对人体的免疫原性,它通过避免抗同种型抗体的产生,减少了HAMA的生成。例如,当鼠对鼠Ig互补决定区(CDR)产生免疫耐受时,用鼠抗-淋巴细胞Ab可以激发抗独特型反应,但相对那些对可变区不耐受的动物来说,该鼠的抗独特型反应被推迟并很微弱。
迄今已研制出很多鼠/人嵌合抗体,有些已陆续进入临床应用,主要用于恶性肿瘤的诊疗,它在预防移植排斥反应也取得了较为满意的效果,在治疗自身免疫疾病以及控制药物过量、药物过敏反应中已显示出巨大优势。但是因为有鼠McAb可变区的存在,应用时仍会引起较强烈的HAMA反应。在此基础上,进一步将鼠McAb可变区中相对保守的FR换成人的FR,仅仅保留抗原结合部位CDR(即CDR移植)—即把鼠抗体的CDR序列移植到人抗体的可变区内,所得到的抗体称CDR移植抗体或改型抗体,也就是真正意义上的人源化抗体。
CDR移植单抗(CDR Grafting Monoclonal Antibody)
完全CDR移植抗体(改型抗体)
完全CDR移植抗体由于鼠源性抗体VR中的骨架区仍残留一定的免疫原性,为最大限度的减少鼠源成分,用人FR替代鼠FR可形成更为完全的人源化抗体,即在此抗体中除了3个CDR是鼠源以外,其余全部是人源结构,这一类型的抗体称为CDR移植抗体或改型抗体。CDR移植抗体中非人序列含量低(约5%),研究已证实其免疫原性大大减小,并且在人体内的血清半衰期延长。
CDR移植技术的理论依据是:
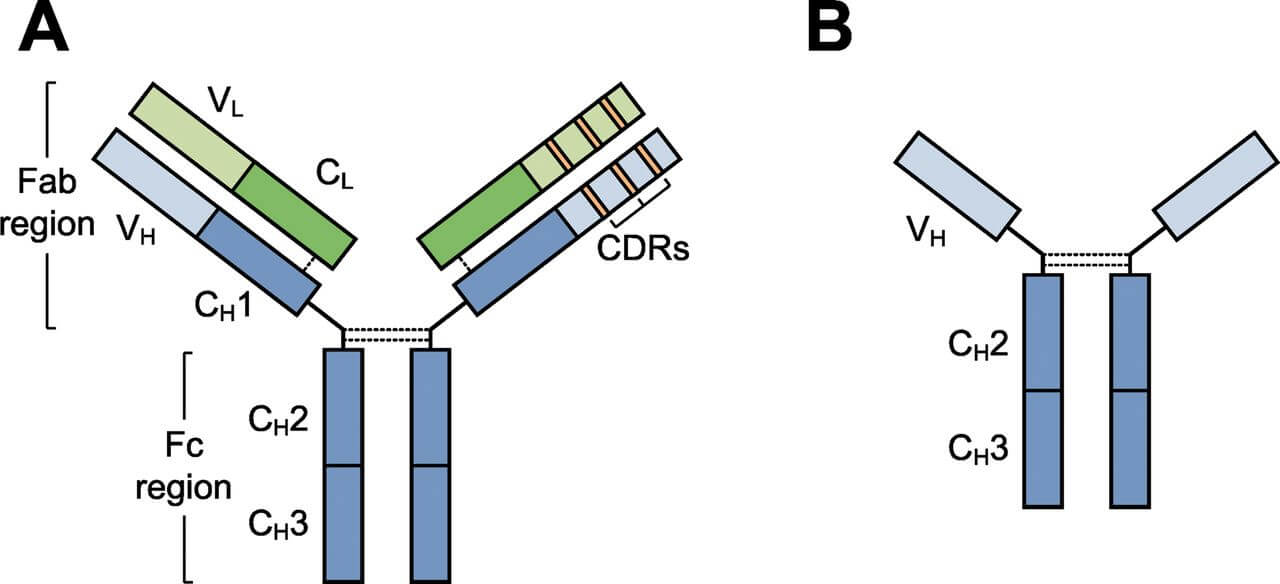
- CDR是决定抗原结合位点的唯一结构,因而也是抗体特异性和亲和力的决定部位。
- 框架区能够接受外源CDR的植入。CDR移植不仅可以降低mAb的免疫原性,而且还可以把鼠源mAb与Ag结合的性质授予人抗体。
应用这一策略,将鼠源McAb的CDR区完全移植,得到了抗磷脂酰肌醇(蛋白)聚糖嵌合抗体。但随后多项研究发现,简单的CDR移植往往明显降低抗原-抗体反应的亲和力,甚至丧失与抗原结合的能力。其原因在于FR不仅作为骨架对CDR起到支持作用,FR中的某些非CDR区补充调控残基还为CDR的回折构象提供必要的支持,其形状和侧链大小协同决定CDR的基本结构,影响CDR与抗原结合的特异性和亲和力。
部分CDR移植抗体
在简单CDR移植的基础上又相继发展了部分CDR移植技术。研究发现轻链的 CDR1、CDR2和重链的CDR3对保证抗体与抗原特异性结合至关重要,其余三个CDR的作用则较低。因此只将抗体结合抗原必须的CDR移植到人抗体的FR骨架上即能获得对人免疫原性更小的嵌合抗体,这类抗体称为部分CDR移植抗体。目前,对CDR移植的人源化路线是,在鼠/人嵌合抗体的基础上,通过数据库检索、计算机分子模拟等寻找出有最大同源性的人可变区模板,综合考虑表面残基、与CDR有相互作用或对空间结构有重要影响的残基,确定需要保留和改变的关键残基,再通过模拟基因合成,表达检测实际效果,进行必要的修正,来获得高亲和力的治疗mAb。目前已构建出多种针对不同抗原的CDR移植抗体,有些已应用于临床诊治,并取得了令人满意的效果,如消除肿瘤,延长器官移植生存期,改善类风湿关节炎、全身性脉管炎、感染性疾病及免疫混乱性疾病的临床症状等。
相关文章:人源化抗体构建原则与实验案例
表面重塑抗体
然而,只通过移植CDR序列产生的人化抗体与抗原结合的能力远不及其亲代鼠源Mab。为了恢复其高亲和力,必须对mAb进行进一步的分析、设计、改建工作,使其抗原决定环的结构更加完善。Chothia和LesK首先提出一些框架残基对CDR构象因此的重要性,并综合地检测了所有影响抗原结合的框架残基。Xiang等发现嵌合抗体B72.3的71和93框架残基是重链超变环构象的主要决定部分。因此,可用亲代鼠源抗体的相关序列替代CDR移植抗体V区框架区的关键残基,使CDR构象得以维持。但这同时又增加了鼠源序列的成分,致使免疫原性也加强。从治疗的角度考虑,最好是能够找到框架区变化最小而抗原亲和力又很高的人化抗体。尽管有分子模拟法的指导,但要测定哪些框架变化对抗原结合有益,通常需要分析许多不同的抗体突变型。
该策略作为较新的一种人源化途径,还在逐步成熟阶段。鼠源McAb在人体引起的HAMA反应,究竟是完全由其表面的暴露残基引起,还是由表面残基与内部残基的共同贡献,涉及到抗体产生最基本的免疫学机制,而这种机制仍是目前探讨的热点。尽管有人认为,即使在MHC背景下鼠源McAb被加工和提呈后包埋残基暴露出抗原性,但诱生的抗抗体也只能和降解的或解折叠的原抗体起反应,不会干扰原抗体的治疗效应。
全人源化单抗(Fully Human Monoclonal Antibody)
人源化mAb基本上解决了鼠抗体的最重要问题——免疫原性,但是人源化过程仍很繁复且费用昂贵,它需要广泛的计算机模型设计,即使如此,大量反复试验仍不可避免,因为要试验各种氨基酸置换以测定对目标选择性和结合亲和力的有害作用。而全人源化单克隆抗体是指将人类抗体基因通过转基因或转染色体技术,将人类编码抗体的基因全部转移至基因工程改造的抗体基因缺失动物中,使动物表达人类抗体,达到抗体完全人源化的目的。
目前生产完全人源化抗体的方法主要包括抗体库技术和人源性抗体转基因小鼠技术两种。
抗体库技术
抗体库技术包括噬菌体抗体库技术和核糖体展示技术。
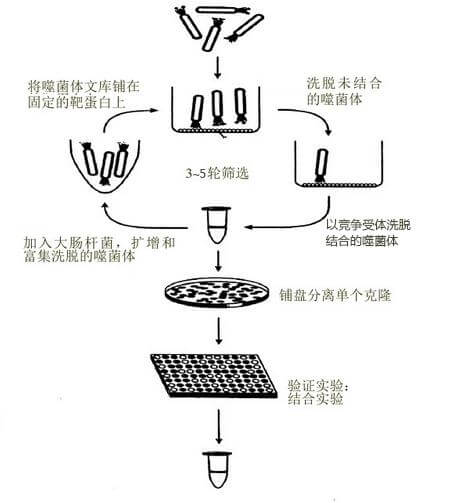 噬菌体抗体库技术:
噬菌体抗体库技术:是利用噬菌体表达外源基因的一项新技术,是将抗体重链可变区(VH)和轻链可变区(VL)基因与噬菌体的外壳蛋白Ⅲ(PⅢ)或外壳蛋白Ⅷ(PⅧ)基因随机重组,继而感染大肠杆菌,后经增殖并在噬菌体表面以抗体片段Fab或单链抗体可变区(ScFv)一外壳蛋白的融合蛋白形式表达。这种噬菌体颗粒可以特异识别抗原,又能感染宿主菌进行再扩增,经过“吸附一洗脱一扩增”过程,就能筛选并富集特异性抗体。所构建的抗体库称为全套抗体库,从中筛选到的抗体称为噬菌体抗体。其最大特点是实现了直接将基因型和表型联系在一起,可以快速而高效地从大量克隆中筛选出表达特异性的抗体。
核糖体展示技术:将基因型和表型联系在一起,编码蛋白的DNA在体外进行转录与翻译,由于对DNA进行了特殊的加工与修饰,
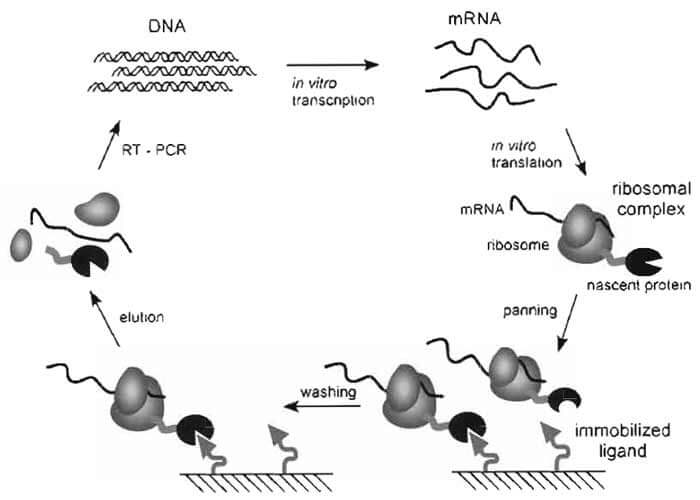
如去掉3′末端终止密码子,核糖体翻译到mRNA末端时,由于缺乏终止密码子,停留在mRNA 的3′末端不脱离,从而形成蛋白质-核糖-2mRNA三聚体,将目标蛋白特异性的配基固相化,如:固定在ELISA 微孔或磁珠表面,含有目标蛋白的核糖体三聚体就可在ELISA 板孔中或磁珠上被筛选出,对筛选分离得到的复合物进行分解,释放出的mRNA 进行
逆转录酶链聚合反应(RT-PCR),PCR产物进入下一轮循环,经过多次循环,最终可使目标蛋白和其编码的基因序列得到富集和分离。
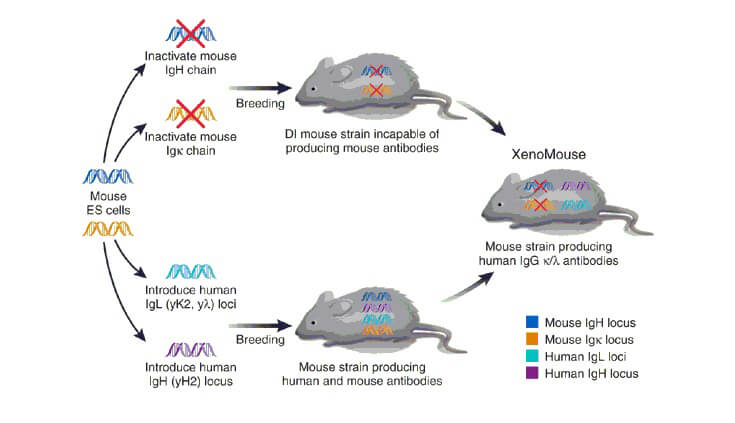
人源性抗体转基因小鼠技术(Transgenic Mouse)
转基因小鼠制备全人源抗体,要求人的抗体基因片段在小鼠体内必须进行较为有效的重排与表达,并且这些片段能与小鼠细胞的免疫系统信号机制相互作用,使得小鼠在受抗原刺激后,这些人抗基因片段能被选择,表达并活化B细胞分泌人抗体。其基本方法是采用在鼠胚胎干细胞(ES)中的同源重组来使得鼠原有基因缺失,再通过显微注射等技术将重建的人源抗体胚系基因微位点转入小鼠体内,最终由mAb的杂交瘤分泌出全人序列的抗体。转基因小鼠制备全人源抗体技术是现在全人源抗体制研究的主流,截至2013年,已有5个由转基因小鼠制备而来的全人源抗体被批准上市,20余个正处在临床试验中。目前主要的转基因小鼠制备全人源抗体技术有HuMAb-Mouse、Xeno Mouse、VelocImmuneTM三种方法。
相关文章:全人源化单克隆抗体制备技术(转基因小鼠)
HuMAb-Mouse: HUMab转基因小鼠整合入人抗体基因450kb(200kb Ig H;230kb Igk,约占人类Ig Gκ的50%),免疫该小鼠可以产生0.1-5nmol/L的抗体。虽然该小鼠转入的人抗体基因组还是比较小,但仍获得巨大成功。
Xeno Mouse: Xeno Mouse转基因小鼠也是目前最为成功、应用最广的转基因小鼠之一。该转基因小鼠整合入大部分人抗体VH和Vκ基因,大小分别为1020kb和800kb。重链包含34个V区基因、所有的重链D区和J区,以及Cγ2、Cμ和Cδ基因,共66个功能基因;轻链包含18个V区基因、所有的5个J区和 Cκ基因,共32个功能基因。该转基因小鼠XMG2-KL可以产生全人IgM和IgG2,亲和力可以达0.1~1nmol/L。
 VelocImmuneTM:
VelocImmuneTM:不同于以往的转基因小鼠抗体筛选平台,VelocImmuneTM产生人可变区与鼠恒定区组成的反向嵌合抗体。小鼠Ig H恒定区通过B细胞胞质区的信号转导区域(如Igα与Igβ)传递天然的免疫信号,并通过与其他类型免疫细胞上的Fc受体的结合促使小鼠产生强大的免疫反应,并提供半衰期长且亲和力高的抗体。该类转基因小鼠免疫后产生的抗体可变区编码序列通过基因克隆技术与人源恒定区编码序列进行构建,反向嵌合抗体即可转变为适宜药用的全人源抗体。
人源性抗体转基因小鼠技术的主要优点是,其功效优于其他生产抗正常人体蛋白mAb技术。小鼠识别抗原和动员抗该抗原的抗体系统仍保持完整,容易把人体蛋白识别为异物。转基因小鼠的另一个优点是,由于抗体是体内产生,经历正常装配和成熟过程,从而保证成品具有较高的靶结合亲和力。
更多阅读
单克隆抗体结构与作用机制
单克隆抗体技术(杂交瘤技术)简介

 第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于异源性Ab的免疫反应约有90%是针对恒定区(C区),要降低mAb的抗原性,必须对Ab的恒定区进行人源化。构建嵌合抗体的大致原理是,从分泌某mAb的杂交瘤细胞基因组中分离和鉴别出重排的功能性可变区(V区)基因,经基因重组与Ig恒定区基因相拼接,插入到适宜的表达载体中,构成鼠/人嵌合的轻重链基因表达质粒,经转染骨髓瘤细胞,通过筛选即可制备出鼠/人嵌合抗体。这种嵌合抗体同鼠源抗体比较至少有以下两个优点:
第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于异源性Ab的免疫反应约有90%是针对恒定区(C区),要降低mAb的抗原性,必须对Ab的恒定区进行人源化。构建嵌合抗体的大致原理是,从分泌某mAb的杂交瘤细胞基因组中分离和鉴别出重排的功能性可变区(V区)基因,经基因重组与Ig恒定区基因相拼接,插入到适宜的表达载体中,构成鼠/人嵌合的轻重链基因表达质粒,经转染骨髓瘤细胞,通过筛选即可制备出鼠/人嵌合抗体。这种嵌合抗体同鼠源抗体比较至少有以下两个优点:
 噬菌体抗体库技术:是利用噬菌体表达外源基因的一项新技术,是将抗体重链可变区(VH)和轻链可变区(VL)基因与噬菌体的外壳蛋白Ⅲ(PⅢ)或外壳蛋白Ⅷ(PⅧ)基因随机重组,继而感染大肠杆菌,后经增殖并在噬菌体表面以抗体片段Fab或单链抗体可变区(ScFv)一外壳蛋白的融合蛋白形式表达。这种噬菌体颗粒可以特异识别抗原,又能感染宿主菌进行再扩增,经过“吸附一洗脱一扩增”过程,就能筛选并富集特异性抗体。所构建的抗体库称为全套抗体库,从中筛选到的抗体称为噬菌体抗体。其最大特点是实现了直接将基因型和表型联系在一起,可以快速而高效地从大量克隆中筛选出表达特异性的抗体。
噬菌体抗体库技术:是利用噬菌体表达外源基因的一项新技术,是将抗体重链可变区(VH)和轻链可变区(VL)基因与噬菌体的外壳蛋白Ⅲ(PⅢ)或外壳蛋白Ⅷ(PⅧ)基因随机重组,继而感染大肠杆菌,后经增殖并在噬菌体表面以抗体片段Fab或单链抗体可变区(ScFv)一外壳蛋白的融合蛋白形式表达。这种噬菌体颗粒可以特异识别抗原,又能感染宿主菌进行再扩增,经过“吸附一洗脱一扩增”过程,就能筛选并富集特异性抗体。所构建的抗体库称为全套抗体库,从中筛选到的抗体称为噬菌体抗体。其最大特点是实现了直接将基因型和表型联系在一起,可以快速而高效地从大量克隆中筛选出表达特异性的抗体。 如去掉3′末端终止密码子,核糖体翻译到mRNA末端时,由于缺乏终止密码子,停留在mRNA 的3′末端不脱离,从而形成蛋白质-核糖-2mRNA三聚体,将目标蛋白特异性的配基固相化,如:固定在ELISA 微孔或磁珠表面,含有目标蛋白的核糖体三聚体就可在ELISA 板孔中或磁珠上被筛选出,对筛选分离得到的复合物进行分解,释放出的mRNA 进行逆转录酶链聚合反应(RT-PCR),PCR产物进入下一轮循环,经过多次循环,最终可使目标蛋白和其编码的基因序列得到富集和分离。
如去掉3′末端终止密码子,核糖体翻译到mRNA末端时,由于缺乏终止密码子,停留在mRNA 的3′末端不脱离,从而形成蛋白质-核糖-2mRNA三聚体,将目标蛋白特异性的配基固相化,如:固定在ELISA 微孔或磁珠表面,含有目标蛋白的核糖体三聚体就可在ELISA 板孔中或磁珠上被筛选出,对筛选分离得到的复合物进行分解,释放出的mRNA 进行逆转录酶链聚合反应(RT-PCR),PCR产物进入下一轮循环,经过多次循环,最终可使目标蛋白和其编码的基因序列得到富集和分离。 VelocImmuneTM:不同于以往的转基因小鼠抗体筛选平台,VelocImmuneTM产生人可变区与鼠恒定区组成的反向嵌合抗体。小鼠Ig H恒定区通过B细胞胞质区的信号转导区域(如Igα与Igβ)传递天然的免疫信号,并通过与其他类型免疫细胞上的Fc受体的结合促使小鼠产生强大的免疫反应,并提供半衰期长且亲和力高的抗体。该类转基因小鼠免疫后产生的抗体可变区编码序列通过基因克隆技术与人源恒定区编码序列进行构建,反向嵌合抗体即可转变为适宜药用的全人源抗体。
VelocImmuneTM:不同于以往的转基因小鼠抗体筛选平台,VelocImmuneTM产生人可变区与鼠恒定区组成的反向嵌合抗体。小鼠Ig H恒定区通过B细胞胞质区的信号转导区域(如Igα与Igβ)传递天然的免疫信号,并通过与其他类型免疫细胞上的Fc受体的结合促使小鼠产生强大的免疫反应,并提供半衰期长且亲和力高的抗体。该类转基因小鼠免疫后产生的抗体可变区编码序列通过基因克隆技术与人源恒定区编码序列进行构建,反向嵌合抗体即可转变为适宜药用的全人源抗体。