免疫球蛋白A(IgA)是呼吸道、胃肠道等黏膜表面分泌物中的主要抗体类别,由IgM通过抗体类别转换而来。IgA具有抑制细菌和病毒与上皮细胞的粘附,中和细胞内外病毒和细菌毒素的功能,被认为是抵御许多入侵病原体的重要第一道防线。IgA也是一种较弱的补体激活剂,在抗原有限的情况下,通过阻断强激活补体剂IgG或IgM抗体的结合抑制补体激活。
与其它免疫球蛋白(Ig)相同,IgA单体也由2条相同的重链和轻链组成,顶端2个Fab区可识别抗原,Fc区可与各种受体和效应分子相互作用。Fab区和Fc区由一个灵活的铰链区隔开。与其他Ig不同,IgA重链为α链,CH3包含一个称为尾部(Tp)的18个氨基酸C末端延伸。
在人体内IgA存在IgA1和IgA2两个亚类,IgA1是全身免疫系统产生的主要IgA亚类,IgA2主要存在于结肠。IgA1、IgA2重链恒定区(即Cα1、铰链、Cα2和Cα3)铰链序列差异显著(图1)。IgA1包含一个重复的八肽序列,范围大易水解;IgA2敏感铰链区序列缺失,抗蛋白酶水解能力更强。IgA2包含IgA2m(1)和IgA2m(2)两种同种异型,IgA2m(2)的H、L链通过二硫键连接,结构稳定;IgA2m(1)通过非共价相互作用,结构松散易分离。分子结构显示IgA1的2个Fab顶端间距比IgA2m(1)更大(图2),为此IgA1可能对表面具有重复抗原结构的病原体有更高的亲和力。
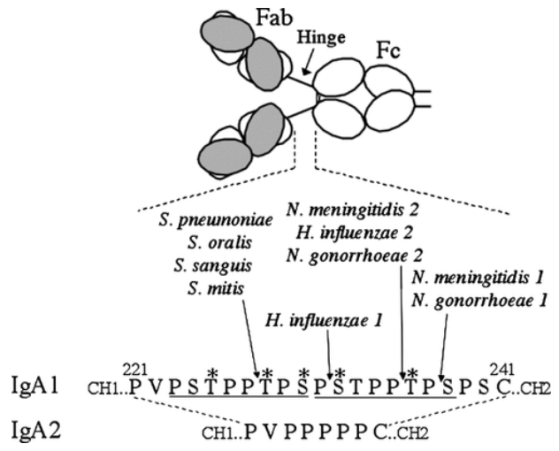
图1 人IgA1和IgA2铰链区比较
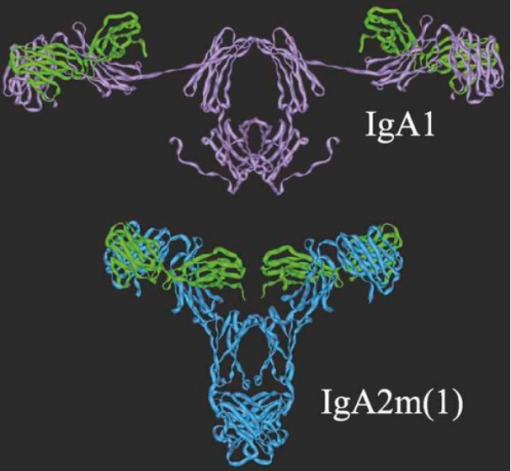
图2 人IgA1和IgA2m(1)分子模型
注:IgA1、IgA2m(1)轻链为绿色;IgA1重链为紫色,IgA2m(1)重链为青色。(图片来源于参考文献[3])
IgA在体内有分泌型IgA(SIgA)和血清IgA两种,分别来源于分布于黏膜相关淋巴组织的浆细胞和骨髓及外迁至脾中的浆细胞。分泌型IgA(SIgA)存在于唾液、眼泪、初乳、肠道、生殖道以及呼吸道的分泌物中,大多以聚合物(pIgA)形式存在,主要由二聚体(dIgA)组成。分泌型IgA(SIgA)分子量为385 kD,平均血清浓度为0.05 mg/mL。pIgA由IgA单体Fc区与J链尾部倒数第二个Cys残基通过二硫键连接而成。与单体相比,pIgA含有多个Fab,具有更强的抗原亲和力,更易于凝集外部分泌物中的微生物。
血清IgA直接分泌到血液中,以单体形式存在,其中约90%是在骨髓中产生的IgA1单体。血清IgA分子量为160 kD左右,占总Ig的10%–15%,浓度仅次于IgG(12 mg/mL)约为2-3 mg/mL,产生速率与IgG相似,但代谢速度比IgG快五倍。
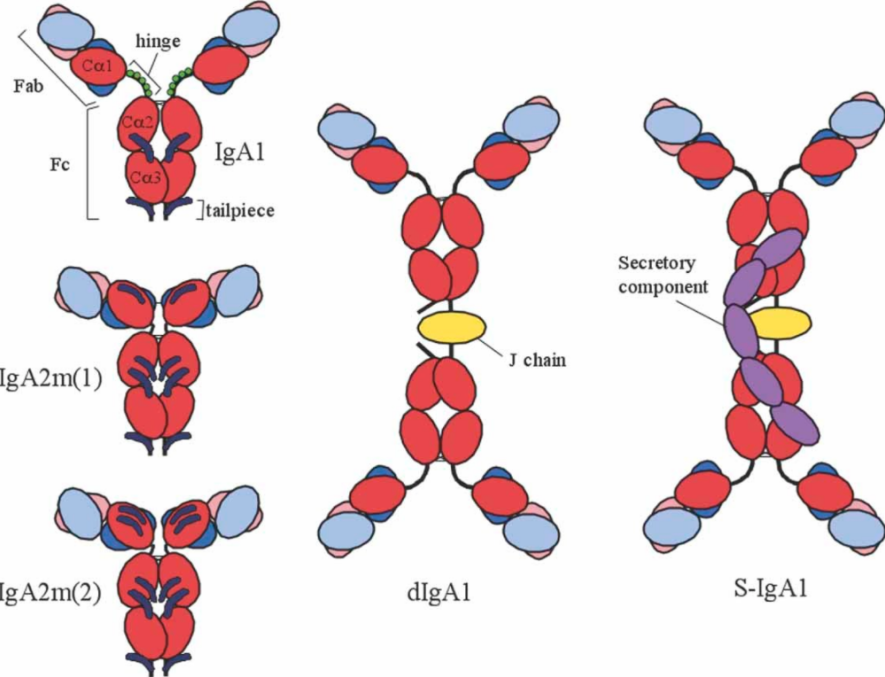
图3 人IgA1、IgA2m(1)、IgA2m(2)、dIgA1以及SIgA1示意图
注:重链恒定区为红色,可变区为粉红色。轻链恒定区为蓝色,可变区为淡蓝色。J链为黄色,分泌成分为紫色。在IgA的单体形式上,O-糖基化为绿色(在IgA1铰链上),N-糖基化为深蓝色。(图片来源于参考文献[3])
pIgR介导的IgA黏膜上皮转运及功能
IgA由黏膜上皮固有层中的局部浆细胞(PC)产生。pIgA通过J链与聚合免疫球蛋白受体(pIgR)在基底外侧表面结合,形成的pIgR-IgA复合物被内吞(图4-③)并通过一系列囊泡穿过细胞被传递到顶端表面。在顶端表面的pIgR蛋白水解,释放SC-pIgA复合物(SIgA)或游离分泌成分(SC)(图4-④)。SC是一种亲水性和高度糖基化带负电荷的分子,在腔分泌物中,IgA与SC的共价偶联可以提升SIgA的亲粘特性和抗蛋白酶水解的稳定性。
转运过程中pIgA可以结合、中和和消除病毒。浸润的抗原和病原体被pIgA转运回管腔。亚上皮树突状细胞(DC)可以呈递抗原或吸收通过微皱褶细胞(M细胞)进入的SIgA包被的病原体。固有层中的病原体被dIgA包被形成免疫复合物,由表达FcαRI的DC和中性粒细胞摄取。中性粒细胞分泌白三烯B4(LTB4),吸引更多的中性粒细胞,从而清除感染。
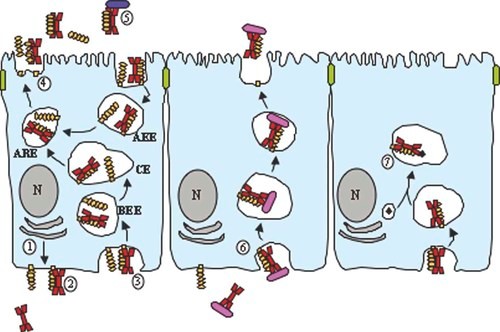
图4 聚合免疫球蛋白受体(pIgR)介导的IgA黏膜上皮转运示意图
注:图中为上皮的简化横截面,顶部和底部分别具有顶端和基底外侧表面。pIgR为橙色,聚合IgA为红色,细胞核(N)和内质网为灰色,细菌病原体为深蓝色和粉红色,病毒病原体为黑色菱形。BEE为基底外侧早期核内体;CE为共核内体;ARE为顶端再循环内体;AEE为顶端早期内体。(图片来源于参考文献[3])
肠道系统中的SIgA功能
SIgA在维持对无害共生物的耐受及病原体免疫力平衡方面具有重要作用。在肠道系统中,SIgA从上皮层释放到管腔,存在于外粘液层中,SIgA涂层发挥分子“油漆”作用,干扰细菌运动并包围具有亲水外壳的病原体,阻止病原体进入肠上皮。SIgA通过抗体介导的表面抗原交联会凝集细菌,中和酶、毒素等细菌产物,再通过肠蠕动去除细菌聚集体。SIgA与粘液层形成抵抗病原微生物的天然屏障,共同防止病原微生物在黏膜上皮定植和渗透,避免感染。
FcαRI介导的IgA功能
血清IgA免疫复合物通过亲和力结合并交联FcαRI激活免疫细胞,从而诱导促炎反应,消除病原体。单体IgA通过可能IgAFc受体(FcαRI;CD89)抑制ITAMi信号传导维持稳态。由于pIgR相互作用位点与FcαRI部分重叠,SIgA与FcαRI结合受阻,无法通过FcαRI促进吞噬作用,但SIgA能够通过FcαRI和凝集素Mac-1(CD11b/CD18)的共同刺激呼吸爆发。与IgG或IgM相比,IgA在从血液中清除病毒的作用很小,并且对于再次接触病毒后对全身性病毒的保护性免疫是非必需的。
参考文献
[1] Sterlin D, Mathian A, Miyara M, et al. IgA dominates the early neutralizing antibody response to SARS-CoV-2[J]. Sci Transl Med, 2021, 13(577):eabd2223.
[2] Wang Z, Lorenzi JCC, Muecksch F,et al. Enhanced SARS-CoV-2 neutralization by dimeric IgA[J]. Sci Transl Med, 2021, 13(577):eabf1555.
[3] Macpherson, A., McCoy, K., Johansen, FE., et al. The immune geography of IgA induction and function[J]. Mucosal Immunol, 2008, 1(1):11–22.
[4] Breedveld A, van Egmond M. IgA and FcαRI: Pathological Roles and Therapeutic Opportunities[J]. Front Immunol, 2019, 10: 553.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策