体液免疫应可能产生IgM、IgD、IgG、IgA和IgE同种型的免疫球蛋白,每种免疫球蛋白都拥有独特功能,能够介导宿主防御入侵的病原体。IgM是进化过程中最早出现的,在脊椎动物中最为保守的抗体,也是所有脊椎动物唯一共有的抗体。IgM最初是以B细胞受体(BCR)的形式在B细胞分化早期中表达产生。在免疫反应的后期,IgM以含有10个抗原结合位点和连接(J)链的可溶性五聚体的形式,或含有12个抗原结合位点且无J链的六聚体的形式由浆细胞分泌产生。五聚体或六聚体IgM的分子量分别约为900或1050 kDa。由于IgM的多价性质,其表现出比二价IgG更高的抗原亲合力(avidity)。
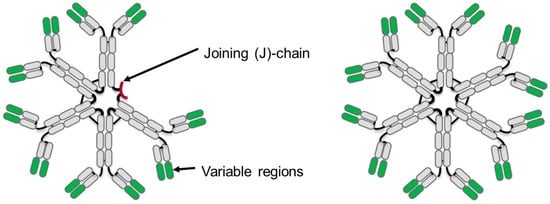
图1 IgM抗体五聚体(左)和六聚体(右)
注:恒定区域以灰色显示,可变区域以绿色显示,IgM五聚体上有以红色显示的J链。
IgM抗体通常以五聚体或六聚体的形式存在,其中每个单体约为190 kDa,由具有5个结构域(Vμ、Cμ1、Cμ2、Cμ3和Cμ4)的重μ链和具有2个结构域(Vκ-Cκ或Vλ-Cλ)的轻链组成。与其他同种型相比,IgM恒定区与IgE的同源性更大。IgG的重链恒定区CH1,CH2和CH3对应于IgM的Cμ1,Cμ3和Cμ4,IgG的铰链区对应于IgM的Cμ2,这是在其他同种型(哺乳动物IgE和禽类IgY)中发现也发现的额外恒定区。Cμ2的功能与IgG的铰链区域非常相似,并且提供了允许IgM在细胞表面上结合多个抗原所需的灵活性。每个单体中的重链在Cys 337处以二硫键共价连接。每个轻链都与重链中136位置的半胱氨酸残基结合。
μ链的另一个特征是在C端存在一个短的18个氨基酸肽序列(PTLYNVSLVMSDTAGTCY),称为尾部肽(tailpiece)。IgM单体通过这些尾部肽的倒数第二个半胱氨酸之间的二硫键共价连接。尾部肽对于IgM聚合至关重要。事实上,尾部肽在其它抗体同种型(如IgG)的C末端融合时,可以诱导聚合。此外,Cμ3中Cys 414残基之间的单体间二硫键将IgM良好的保持为环状结构。
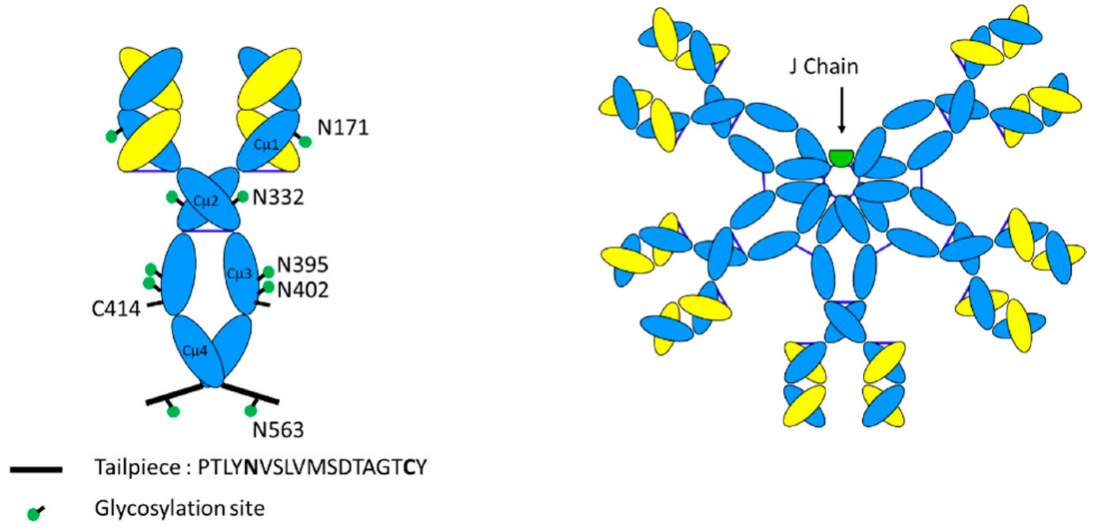
图2 IgM单体与IgM五聚体的关系示意图
注:IgM单体与IgG单体的区别在于它们在指示(绿色点)的天冬酰胺残基处的广泛糖基化,存在额外的结构域Cμ2代替铰链,以及存在对多聚化至关重要的短尾部肽序列。五聚体IgM还具有额外的137个氨基酸组成的J链。
除重链和轻链外,IgM还拥有第三条链,即一种由137个氨基酸组成的多肽,称为连接(J)链,这是IgA和IgM抗体聚合的关键特征。J链是一个独立的结构域,与重链和轻链的蛋白质折叠无关。从两栖动物到人类,J链的序列高度保守,在功能上帮助IgM五聚体和IgA二聚体通过与多聚免疫球蛋白受体(pIgR)的相互作用结合,运输到膜表面,体现了关键结构与功能相统一观点。
抗体是具有N连接糖基化的糖蛋白。IgG在Asn 297处存在N-糖基化,影响其与Fc γ受体的结合,在调节抗体依赖性细胞毒性(ADCC)中起作用。值得注意的是,与IgG相比,IgM具有更多的糖基化位点。IgG重链只具有单个糖基化位点,但人和非人灵长类动物IgM重链在Asn 171(Cμ1),Asn 332(Cμ2),Asn 395,Asn 402(均在Cμ3中)和Asn 563(位于尾部肽中)表现出5个N-糖基化位点。另一个糖基化位点存在于Asn 49的J链上。这些糖基化被认为有利于IgM结构的聚合和组装,并为IgM提供更高的溶解度和更长的体内半衰期。暂没有证据证明IgM的糖基化与介导其他效应有关。
糖基化位点增加了IgM抗体的复杂性。对IgM具体位点特异性糖类分析表明,并非所有N-连接位点都具有相似的糖基化。N-糖基化具有各种复杂程度,从高甘露糖、简单聚糖到双触角、三触角和四触角复合聚糖。Asn 171,Asn 332和Asn 395的三个位点表现为具有唾液酸苷化末端的复杂糖类。Asn 402和Asn 563更多为羧基末端的高甘露糖结构。这种糖基化模式与IgM N端区域更容易被细胞内高尔基体的糖基化酶接近,而C端区域没有充分修饰可能是由于空间位阻使得聚糖与聚合形式IgM间缺乏可及性。IgM上的第四个糖基化位点(Asn 402)与IgG的单位点同源,已知其具有有限的可及性,在IgM或IgG中都未连接复杂糖类。
尽管已知μ链尾部肽和J链在IgM抗体的组装和功能中起着关键作用,但多年来,IgM五聚体的三维结构在很大程度上未有定论。事实上,直到最近对J链二级结构的认知才有所进展。在新的关键研究中,展示了IgM五聚体的冷冻电子显微镜(cryo-EM)结构,令人惊讶的是,IgM五聚体并没有像假设的那样形成五边形结构,而是以不规则的五边形形式,在五个IgM单体中的两个之间有一个 50°角的间隙。
后有研究发现,这个间隙可以结合一种血清蛋白,即巨噬细胞表达的细胞凋亡抑制剂(AIM/CD5L)。因此,分泌型IgM不仅作为效应蛋白,而且还可以作为另一种效应蛋白的转运蛋白。
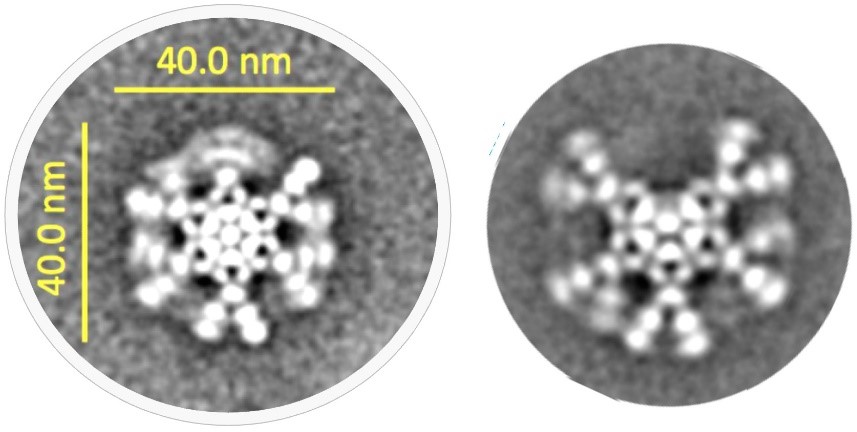
图3 抗CD20 IgM的六聚体(左)和五聚体(右)形式的冷冻电镜下的结构图
在哺乳动物中,B细胞发育在胚胎发育期间以层级、有序的方式在胎儿肝脏中发生,后在成人的骨髓和外周淋巴组织中发生。在骨髓中,CD34+多能祖细胞分化成常见的淋巴细胞前体(CLP),产生B细胞和T细胞谱系。CLP随后分化成表达Igα和Igβ的早期祖B细胞,Igα和Igβ是BCR信号传导的基本组成部分。
在向祖B细胞过渡期间,发生μ链(μHC)位点重排。RAG1/2重组复合物首先诱导D-JH重排,随后V-DJH重排。B细胞分化成large pre-B细胞之前,细胞表面不表达μHC,large pre-B细胞阶段,细胞表面表达BCR前体,由μHC复合物及替代轻链VpreB和λ5链组成。通过BCR前期的信号传导导致增殖、分化和随后的替代轻链下调,为λ或κ轻链重排,形成具有不同抗原特异性的表面IgM铺平了道路。受体编辑和选择发生在此时发生,表面表达IgM的未成熟B细胞从骨髓流出到脾脏。
在脾脏内,表达IgM的未成熟B细胞开始在细胞表面表达IgD,其分为以下不同的群体:在滤泡内的低表达IgM高表达IgD B细胞和在脾脏的边缘带的高表达IgM低表达IgD B细胞。B1细胞也成熟成高表达IgM低表达IgD细胞。尽管IgM和IgD的可变区相同,但选择性转录和剪接都会影响IgM和IgD重链。这些未成熟B细胞群现在已经成熟,并且在遇到抗原时可以进行克隆扩增和体细胞超突变。抗原结合后,通过IgM和/或IgD BCR启动信号传导,通过共受体CD19产生涉及Lyn、Syk、Src、Btk、PLCγ2和PI3Kδ的信号级联,导致产生分泌IgM、IgG、IgA或IgE的B细胞的活化、增殖和分化。而B1细胞仅产生分泌型IgM。
参考文献
Keyt BA, Baliga R, Sinclair AM, et al. Structure, Function, and Therapeutic Use of IgM Antibodies. Antibodies: 2020;9(4):53. doi:10.3390/antib9040053

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策