
纳米抗体(VHH)是骆驼科动物IgG2和IgG3抗体重链的可变结构域(不含CH1结构域及轻链)表达产生的功能性片段(图1)。它们代表了最小的,能够保持原始全抗结合能力、亲和力和特异性的抗体片段(14kDa),并因其结构稳定性,可以进行抗体工程设计,制成适用于体外和体内应用的免疫试剂。相对于传统的IgG(150kDa),纳米抗体的微小尺寸赋予了与病毒隐蔽表位结合的独特能力,这一特性目前适用于生产针对病毒类的研究试剂。
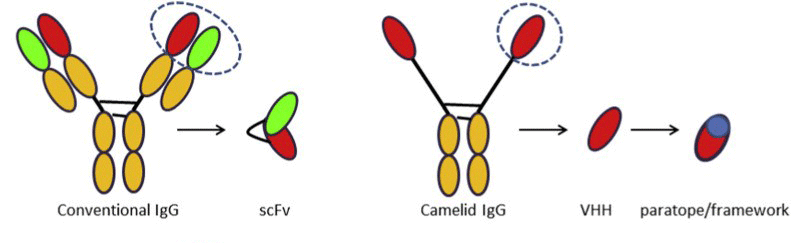
图1 传统抗体、scfv与骆驼科IgG、VHH
近年来,VHH的多功能应用场景持续拓展:其一,作为蛋白结构解析的高效晶体学伴侣及分子工具;其二,充当短半衰期放射性同位素载体,用于体内PET/SPECT成像;其三,成为纳米颗粒、纳米凝胶与生物传感器的定向免疫试剂,在特定前导肽介导下甚至可实现哺乳动物细胞内化。此外,其微小尺寸备受超分辨率显微镜结合剂研究者青睐,亦可通过串联嵌合抗原受体(CARs)实现多抗原协同结合,显著提升靶向特异性。尤为重要的是,VHH的短序列特性使其成为通过理性设计与计算机辅助优化改良生物物理特性的理想工程化抗体平台。
纳米抗体的广泛应用已推动其技术链的成熟化发展——从制备分离、表达纯化、工程改造直至最终免疫试剂开发,均建立了系统的解决方案。当前,针对不同功能需求定制化生产VHH的原核与真核表达载体体系日益完善,可精准适配各类终端应用场景。
纳米抗体通常在细菌系统中可实现功能性高产量表达,但在特定应用场景下仍需依赖哺乳动物细胞等成本更高的表达体系。例如,当需通过与Fc融合恢复体内ADCC/CDC效应功能,并利用二价分子增强表观亲和力时,必须采用哺乳动物系统以获得正确糖基化的活性分子。若Fc融合仅作为体外应用的纯化标签(如Protein A或二抗结合),则可在细菌系统中表达非糖基化VHH-Fc,其抗原结合能力依然完整保留。
对于难以在细菌中表达的融合蛋白(如辣根过氧化物酶),传统方案依赖哺乳动物细胞生产功能性纳米抗体-酶嵌合体,已成功应用于竞争性ELISA等诊断技术。当纳米抗体需在体内维持功能(如细胞内靶向治疗),哺乳动物表达系统具有不可替代性。其核心优势在于可时空精确调控表达:例如在特定生理阶段诱导荧光纳米抗体表达,实时追踪抗原动态而不干扰细胞活性;或设计竞争性抗体阻断病理蛋白聚集。此类应用依托于VHH的结构特性——其二硫键在某些构型中非必需,具有此特质的纳米抗体可在胞质内正确折叠,无需分泌途径参与天然构象形成。基于此开发的”胞内抗体”技术,通过标签-纳米抗体正交系统选择性调控靶蛋白活性,为真核细胞功能研究提供新范式。预计未来蛋白特异性纳米抗体将取代标签抗体,以这种方式更灵活地实现多维分析。
在病毒中和研究领域,哺乳动物胞质表达可精准评估表位特异性:如稳定表达抗HIV Rev蛋白的纳米抗体,通过测试其对天然Rev变体的病毒复制抑制能力,鉴定出中和关键残基并预测其对HIV-1亚型的疗效。该技术同样赋能治疗性载体开发——展示靶向肿瘤纳米抗体的重组细胞外囊泡,可实现治疗药物的定向递送。
大肠杆菌周质分泌是重组纳米抗体生产的常规策略,其氧化环境利于稳定二硫键形成。经渗透休克透化外膜后,可从上清液回收正确折叠的纳米抗体。纯化主要采用亲和层析法,针对热稳定性优异的VHH变体,还可通过热变性处理上清液实现高效回收。
该体系存在两大固有缺陷:1)分子伴侣系统缺陷易致高表达量下的错误折叠与聚集;2)有限周质空间引发的分子拥挤效应显著降低产量。
细菌胞质的还原性环境虽会抑制纳米抗体二硫键形成,但约50%的驼源VHH无需二硫键即可完成功能性折叠。此类天然无二硫键变体可通过筛选直接获得,或经分子改造(如Cys→Ser/Ala突变)实现去二硫键化。
针对含二硫键的VHH,可采用两类胞质表达策略:
分泌表达可通过培养基直接回收重组蛋白,显著降低杂质负载。该策略虽避免细胞裂解步骤,但需额外离心/过滤处理,且大体积上样延长层析时间。基于溶血素转运系统的纳米抗体分泌已实现功能性表达,但低产率制约其应用。
相较于分泌途径,包涵体作为高均一度蛋白源尚未广泛应用于纳米抗体生产。理论而言,VHH的结构特性应利于重折叠方案优化:包涵体形式表达的纳米抗体经尿素溶解与金属亲和层析后,复性效率显著提升(可达周质可溶性表达产量水平),但其构象与功能完整性仍需严格验证。最新研究表明,通过复性条件系统性筛选(如氧化还原缓冲体系梯度优化),可同步提高包涵体源纳米抗体的可溶得率及功能活性。
纳米抗体在细菌/酵母表面展示时可自发折叠为功能活性构象,该特性已广泛应用于全细胞生物传感器构建及高通量筛选。细胞表面展示技术具备三重核心优势:免纯化步骤、规避表面固定化工程、天然外向型定位。此类展示细胞可直接作为生物传感器的捕获元件或ELISA检测试剂;也可利用其溶液聚集效应实现抗原定量,相较传统”纯化-功能化”流程显著提升效率并降低成本。虽难以精确定量表面VHH密度,但可通过表达调控调整结合剂丰度。
酵母表面展示主要用于抗体片段文库淘选,通过流式细胞术对选定克隆进行分选。与噬菌体展示相比,酵母系统有巨大的优势——无需手动分选后回收克隆。基于酵母展示平台的表达革新策略,通过DTT诱导断裂展示蛋白与VHH间的二硫键,从而实现纳米抗体直接从酵母细胞中释放。纳米抗体与多种标签融合表达(如生物素化)用于SPR分析,无需亚克隆、表达和纯化。
获得纳米抗体序列后,应根据最终应用场景(如:诊断检测、结构研究、体内治疗)设计表达方案。目前广泛使用的模块化pET载体已集成以下优化设计:
纳米抗体及其融合标签的表达方式正日益多样化,以满足不同应用场景对试剂高度差异化特性的需求,这导致其生产工艺需依赖更多样的表达条件。同时,研究逐渐揭示纳米抗体的结构复杂性远超早期认知——其抗原结合位点并非单一固定构型,而是能通过框架残基参与形成多种三维构象,从而赋予抗原结合界面的多样性。尽管缺乏直接实验证据,但可推测不同VHH亚型的折叠需求可能存在差异,因此建模时必须精准选择参考结构。综上,为满足未来功能可靠性的要求,实现高度差异化的纳米抗体免疫试剂生产可能需要更多而非更少的表达系统支撑。
参考文献
de Marco A. Recombinant expression of nanobodies and nanobody-derived immunoreagents. Protein Expr Purif. 2020 Aug;172:105645. doi: 10.1016/j.pep.2020.105645.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved