
酵母双杂交系统,又称蛋白阱捕获系统,是由Fields和 Song等人根据真核转录调控的特点创建的。利用酵母双杂交系统能够快速、直接分析已知蛋白之间的相互作用,并能寻找、分离与已知蛋白相互作用的配体,在研究抗原和抗体相互作用、发现新的蛋白质和发现蛋白质的新功能、筛选药物作用位点及药物对蛋白互作影响、建立基因组蛋白连锁图等方面应用广泛。
酵母双杂交系统的建立是基于对真核生物转录调控过程的认识。真核生物中基因转录需要转录激活因子的参与,真核生物的转录激活因子含有两个不同的结构域:DNA结合结构域(DNA binding domain,DNA-BD)和DNA转录激活结构域(Activation domain,AD),这两个结构域可以独立分开,功能互不影响。BD和AD分别单独作用并不能激活转录反应,只有当二者在空间上充分接近时,才呈现完整的转录激活因子活性,使下游基因得到转录。根据这一原理,可设计酵母双杂交系统。
将两待研究蛋白(蛋白X与蛋白Y)分别与BD、AD结构域构建融合质粒。将构建好的两个质粒转入同一酵母细胞中表达,如果两蛋白之间不存在相互作用,则下游基因(报告基因)不会转录表达;如果两个蛋白存在相互作用,则BD与AD两结构域空间上很接近,从而下游基因(报告基因)得到转录。判断通过报告基因表达与否,即可判断两蛋白之间是否存在相互作用。
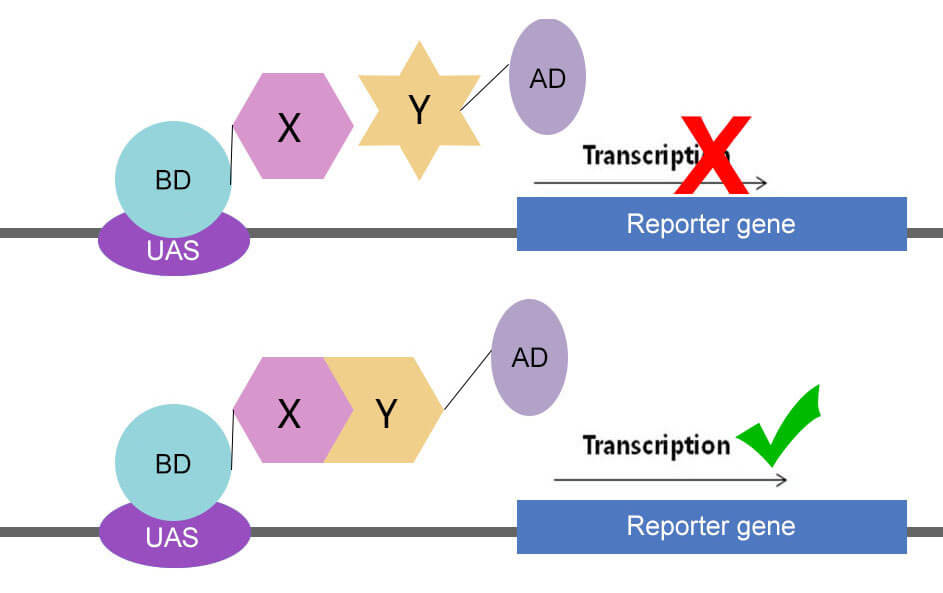
图1:酵母双杂交原理
报告基因作为一种营养标记,常用的有HIS3,URA3,LacZ和ADE2等,对应的宿主菌则是相应标记的缺陷型细胞,必须要在含有该营养标记的培养基中生长。因此,当有相互作用的蛋白存在时,激活报告基因的表达,从而能够在不含营养标记的培养基中生长,以此验证是否存在相互作用。
酵母双杂交系统由三个部分组成:
目前酵母双杂交实验采用的系统有LexA系统和Gal4系统两种。在LexA系统中,DNA结合结构域由一个完整的原核蛋白LexA构成,转录激活结构域则由一个88个氨基酸的酸性的大肠杆菌多肽B42构成,它在酵母中可以活化基因的转录;在Gal4系统中,BD和AD分别由Gal4蛋白上两个不同的结构域(1-147aa与768-881aa)构成。
酵母作为酵母双杂交系统的报道株,它具有诸多优点:易于转化、回收扩增质粒;具有可直接进行选择的标记基因和特征性报道基因;酵母内源性蛋白不易同来源于哺乳动物的蛋白结合。
利用酵母双杂交系统可以直接、快速的研究蛋白-蛋白之间的相互作用,具有敏感性高、操作简便等优点
| 酵母双杂交系统 | 免疫共沉淀(Co-IP) | |
|---|---|---|
| 检测瞬时相互作用 | 是 | 否 |
| 检测弱相互作用 | 是 | 否 |
| 验证方式 | 体内相互作用检测 | 体内相互作用检测 |
| 是否需要蛋白纯化 | 否 | 是 |
| 是否需要抗体 | 否 | 是 |
表1:酵母双杂交与免疫共沉淀对比
假阳性是酵母双杂交实验常遇到的问题,假阳性是指两待测蛋白没有相互作用但依然显示出了阳性结果。产生假阳性的原因很多,如某些蛋白质本身具有激活转录功能或在酵母内表达时发挥转录激活作用,使DNA结合结构域杂交蛋白(BD-bait)在无特异激活结构域的情况下可激活转录。另外有些蛋白质表面有对其它蛋白质的低亲和力区,容易形成蛋白体复合物,能够引起报告基因表达,产生假阳性结果。
为了降低假阳性需要设计正确的对照,应对诱饵蛋白和靶蛋白能否单独激活报告基因做验证。使用两个或两个以上的报告基因也可以降低假阳性,利用两个以上报告基因,只有同时具有两种以上相应表型才是真阳性结果。另外, 将报告基因整合到染色体上,可以使基因表达水平稳定,消除了由于质粒拷贝数变化引起基因表达水平波动而造成的假阳性。
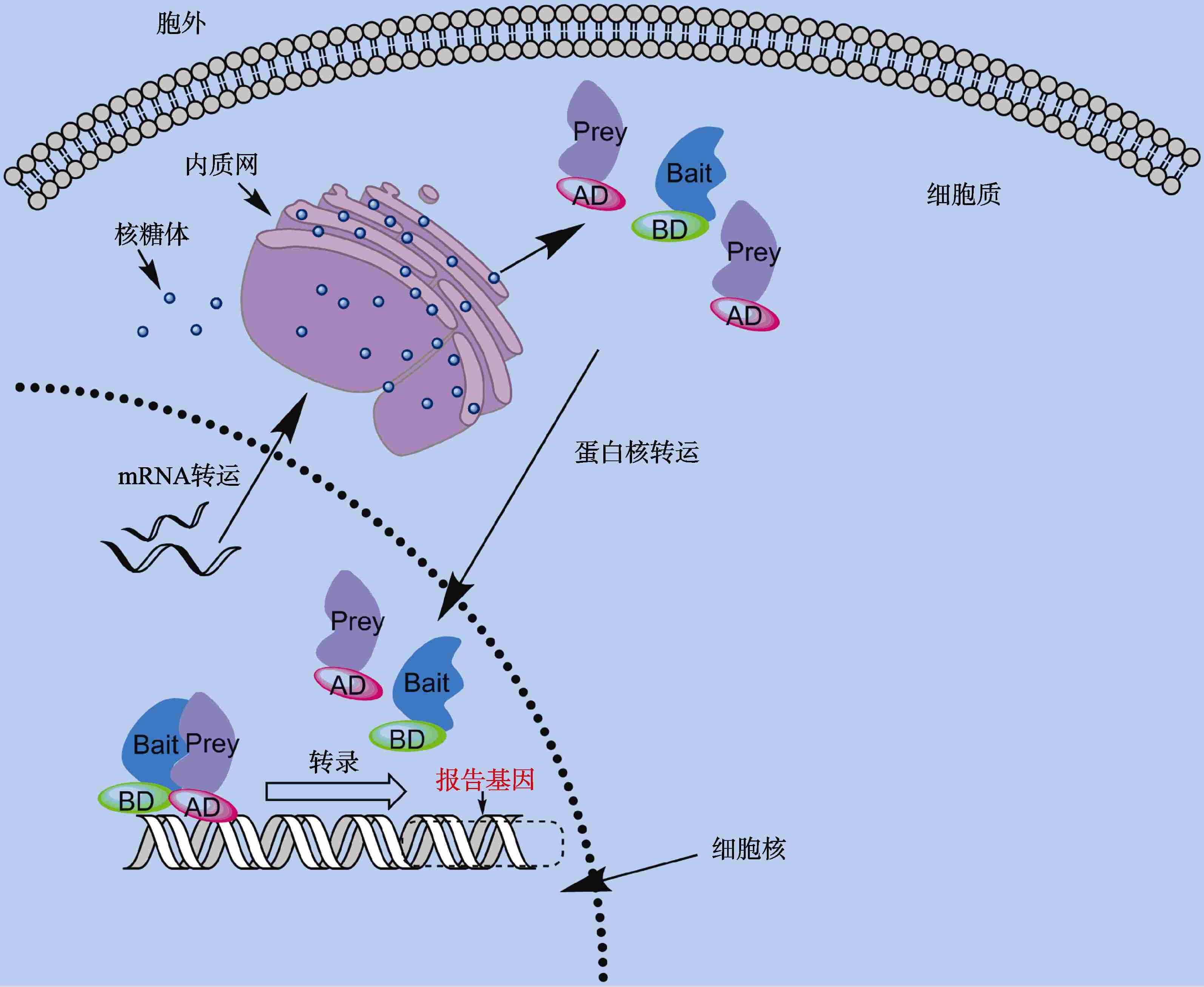
酵母双杂交分析相互作用的蛋白必须定于核内才能激活报告基因,但是很多蛋白质的相互作用依赖于翻译后加工,如二硫键的形成等,而此过程需要在包浆内完成,这样有多种蛋白质不适用此方法。
为了解决这一问题,人们对酵母双杂交技术进行改进,发展了核外双杂交技术(见下文)。
在传统酵母双杂交系统的基础上,发展了多种改型的双杂交技术以适应不同目的需要。
反向杂交技术(也成反式双杂交技术)主要用于在确定蛋白质之间相互作用后,进一步研究其结构和功能的关系,确定蛋白质间作用的关键位点或起决定作用的个别氨基酸、特定结构等。这项技术的特点是采取了反选择筛选策略,其关键是报道基因的表达产物对细胞生长有抑制作用。这样当诱饵蛋白与靶蛋白存在相互作用时,表达出有毒性的报道蛋白,细胞不能生长。
例如Vidal等采用了反式选择性的报告基因URA3,其编码的酶使细胞不能在5一氟乳清酸存在的情况下下生长。如果融合蛋白的相互作用被阻断, URA3则不表达,酵母菌表现对5一氟乳清酸的抗性。因此,采用反式双杂交系统可以很容易地检验出与某一蛋白相互作用的蛋白的突变体。对突变体进行研究,即可找出影响蛋白质间相互作用的关键位点。
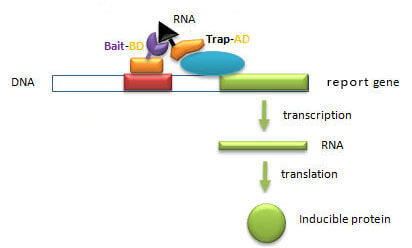
酵母三杂交系统可以用于检测蛋白质-核酸之间的相互作用。三杂交系统的本质与双杂交是相同的,只是需通过第三个分子的介导把两个杂交蛋白带到一起。它的基本原理是将一个已知与RNA结合的蛋白与BD构建第一个融合蛋白,将待测蛋白质与AD构建第二个融合蛋白,同时构建一条含有两个不同结合位点的融合RNA,当RNA与两个融合蛋白相结合时,可激活报道基因的表达。除了蛋白质-核酸之间的相互作用,酵母三杂交系统也可用于检测检测蛋白质与肽配体、蛋白质与有机小配体、蛋白质与蛋白激酶间的相互作用。
在传统的酵母双杂交系统中,蛋白之间的相互作用是在细胞核内发生的。因此,它不能检测某些在核外蛋白之间的相互作用。为了克服这种局限性,发展出了核外双杂交技术。该技术以SRS 和 USPS两种系统为代表。
SRS 也称 Sos 蛋白召集系统 (Sos RecruitmentSystem) 。它的基本原理是分别将待测蛋白X与哺乳动物细胞的一种鸟苷交换因子( EGF) Sos蛋白融合;将Y蛋白与锚定在酵母细胞膜上的Src肉豆寇烯化信号蛋白融合 ,并使它们共表达于一个cdc25-2基因温度敏感型突变的酵母菌株内。由于该菌株中cdc25-2基因编码的 EGF 蛋白在 36 ℃条件下不能激活细胞膜上的Ras蛋白,Ras途径不通。所以细胞无法在36 ℃条件下生存。但如果待测蛋白X与Y之间发生相互作用就能把Sos蛋白带到细胞膜上并激活附近的Ras蛋白,从而打通Ras途径,使该菌株获得在36℃条件下生存的能力。
USPS也称为基于遍在蛋白的裂解蛋白感受器。它的设计是根据这样一个事实,即真核细胞中遍在蛋白与某一蛋白之间新生成的融合会被遍在蛋白特异的蛋白酶(UBPs) 迅速切开,但这种切割只有当遍在蛋白正确折叠时才会发生。研究发现,遍在蛋白基因的N端和C端这两部分即使分离,只要共表达与同一个细胞内,它们仍能正确折叠。将待测蛋白X与带有点突变的遍在蛋白N端片段融合,将待测蛋白Y与下游接有报告蛋白的正常遍在蛋白C端片段融合,并使它们共表达与同一个细胞内。因遍在蛋白N端片段内含有点突变,它与C端片段之间不能自然形成正确的折叠。只有当蛋白X和Y之间发生相互作用时才能克服点突变的影响,使遍在蛋白的两端形成正确折叠,从而引来UBPs切除与C端片段连接的报告蛋白。此技术建立之初是通过Western blot检测有无被切下的报告蛋白来判断待测蛋白之间是否发生了相互作用的,所以操作比较繁琐,不便于推广。最近有人对它作了改进 ,以一种融合的转录激活因子PLV作为报告蛋白。PLV一旦被从遍在蛋白C端片段上切下,它就会进入细胞核内激活特定的报告基因 ,如LacZ和HIS3等。这样就可以根据转化细胞是否生长及显色来判断待测蛋白之间有无相互作用。因此极大地简化了操作步骤,提高了筛选效率。
Fret荧光共振能量转移检测蛋白质间相互作用
TAP串联亲和纯化技术检测蛋白质间相互作用

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved