
1960年Yalow和Berson首次描述了一种使用与放射性信号相连的抗体介导的检测技术,即放射免疫测定技术(radioimmunoassay,RIA)。然而,由于健康风险不得不寻求不涉及放射性信号的方法。某些酶-底物组合产生可量化的颜色变化的发现促进了免疫检测的转变,研究者开发了与抗体连接的酶-底物组合,可以用于检测特定分析物。1971年,欧洲的两个独立研究小组发表了论文,分别描述了进行酶联免疫吸附测定(ELISA)的分步实验过程。
ELISA方法用于检测和定量样品中的特定物质,通常是抗原。将抗原直接或通过称为“捕获抗体”的特异性抗体固定在微孔板中。添加一抗,形成抗原-抗体复合物。一抗或直接用酶标记(即直接ELISA),或通过与酶标记二抗结合(即间接ELISA)。在每个步骤之间,用缓冲液洗涤孔。底物的加入产生指示样品中抗原存在的颜色信号。光密度的测量与样品中抗原的量成正比。
直接ELISA代表用于检测抗原的最简单的一种方法。将含有待测分析物溶液加入到96孔板中,使其在包被在孔内(图1a)。通常使用碳酸盐-碳酸氢盐包被缓冲液,有助于抗原被动吸附到孔。缓冲液pH维持在至少为9,使抗原保持可溶,并确保它们具有可与带正电的板结合的总负电荷。
同时进行标准品、阳性对照和阴性对照的准备。标准品是通常由ELISA试剂盒提供的含有已知浓度分析物的样品。通过在接近预期未知浓度的范围内连续稀释已知浓度的分析物来制备标准曲线。当对血清样品进行ELISA时,通常建议在血清中稀释第二标准曲线,以评估血清中的其他蛋白质是否影响检测(即加标对照)。阳性对照为含有分析物的可溶性样品或纯化蛋白。阴性对照为已知不表达检测到的分析物的样品。
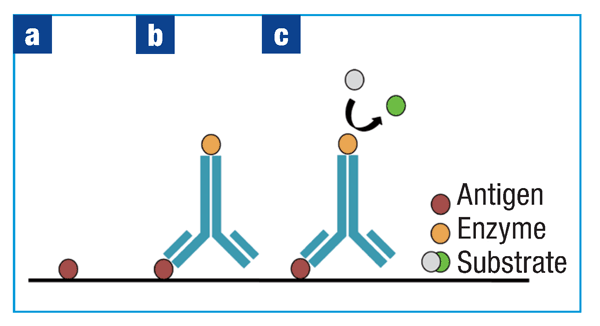
图1 直接ELISA
在抗原包板后,可以处理掉多余的溶液,并加入封闭蛋白覆盖未被抗原包被的孔表面,以限制非特异性结合。在步骤与步骤之间,按照试剂盒的指示,用中性pH的磷酸盐缓冲液洗涤孔,去除未结合的测定组分,这使检测过程中的背景最小化,并提高了测定的特异性。
封闭缓冲液对于饱和未被占用的结合位点是必要的,从而可以最大限度地减少非特异性结合和非特异性蛋白质-蛋白质相互作用。尚未确定标准化封闭缓冲液是否适用于所有试验。理想的封闭缓冲液必须与其他测定组分无交叉反应性,最大限度地减少变性并表现出低酶活性。封闭缓冲液主要包括两类:蛋白质(例如牛血清白蛋白、酪蛋白)和去垢剂(例如吐温20、Triton X-100),需要进行测试以选择最佳的封闭缓冲液并优化流程。封闭缓冲液的选择主要受特定分析成分和孔板表面化学性质的影响。
在此步骤之后,直接和间接ELISA在方案上存在差异。在直接ELISA中,加入偶联酶的检测抗体,使其与包被孔的抗原结合(图1b):将孔板孵育足够长的时间允许抗原-抗体结合,并用磷酸盐缓冲液洗涤除去多余的抗体。然后加入酶的底物,在黑暗环境中为酶-底物相互作用留出足够时间,并用特定溶液停止反应。酶-底物作用形成的颜色变化可以通过酶标仪检测(图1c),并将样品读数与标准曲线进行比较。
在间接ELISA中,抗原固定、封闭和洗涤后(图2a),加入与抗原结合的一抗(图2b):使用碳酸盐-碳酸氢盐包被缓冲液将一抗附着到板上。然后孵育孔板并用缓冲液洗涤,随后加入阻断剂和偶联酶的二抗(图2c)。孵育孔板,洗涤,加入底物,并使用酶标仪扫描孔(图2d)。也可以用荧光标记二抗,并使用荧光计在紫外光下对结果进行定量,即荧光免疫吸附测定(FLISA)。
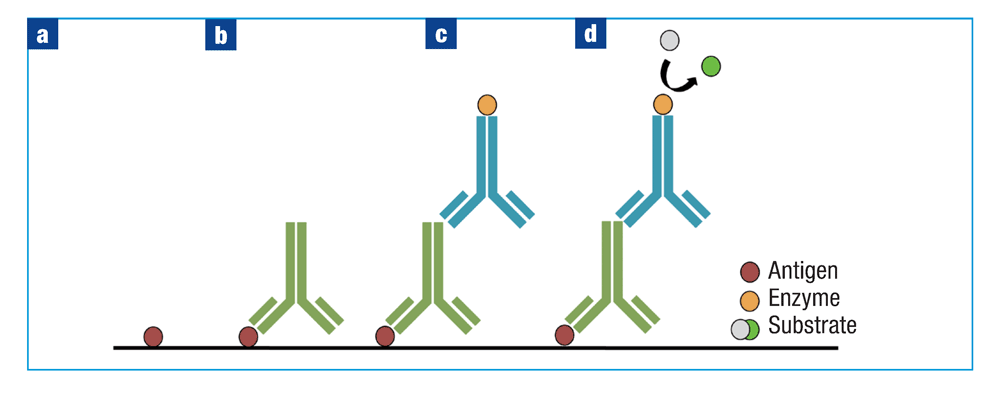
图2 间接ELISA
直接ELISA是一种快速诊断工具。然而,它不能信号放大,因此灵敏度不高。当样本中有高比例的抗原需要评估时,可以优先使用这种方法。抗生物素蛋白/链霉抗生物素蛋白-生物素复合物(ABC)的发展允许分析具有低抗原比例的样品。与荧光团连接的生物素标签用于在间接ELISA中标记第二抗体。亲和素/链酶亲和素-生物素复合物的发展使低抗原比例的样品分析成为可能。每个蛋白分子能够结合多达四个生物素标签,允许多个ABC连接到二抗上,这样可以检测到更强的信号,增加了测定的灵敏度。然而,如果ABC体积太大,可能无法穿透某些组织。
直接ELISA的主要缺点是必须使用特异性抗体,在抗体的选择上没有灵活性,并且标记抗体是耗时且昂贵的。间接ELISA可以使用来自同一个物种的不同一抗,这些一抗可以使用相同二抗标记(易通过商业获得)。然而,二抗有发生交叉反应的可能。所产生的非特异性信号可以使用校准曲线来定量,以相对于被检测的分析物来比较测定。
夹心ELISA分析可以解决一些更复杂的情况,实验的名称源于两种抗体将抗原“夹”在之间的设置(图3)。将含有捕获抗体的包被缓冲液加入到孔板中并使其粘附(图3a)。孵育后,洗涤板并加入封闭缓冲液以封闭孔上剩余的结合位点。然后将样品加入到每个孔中并孵育特定的时间长度(图3b)。
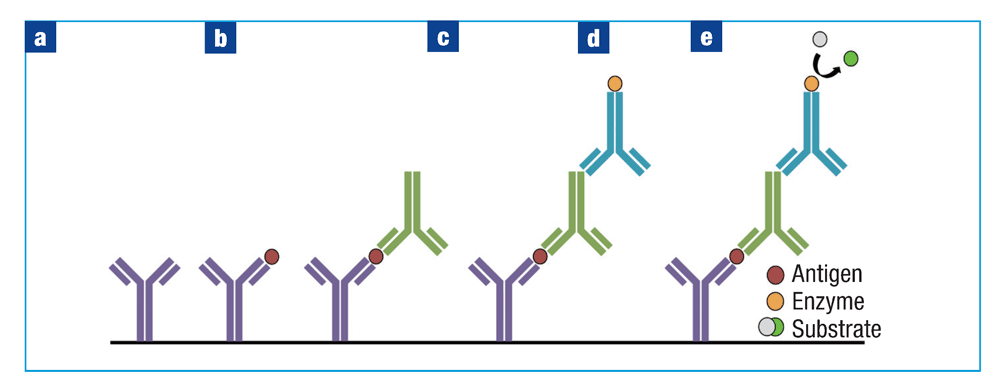
图3 夹心ELISA
为确保结果的准确性,每个孔板必须保留一个标准样品(阳性对照)和一个空白样品(阴性对照)孔。向每个孔中加入检测抗体(图4c),随后加入偶联二抗和封闭缓冲液(图4d)。在每个步骤之间,用磷酸盐缓冲液洗涤孔。加入底物溶液并使用酶标仪检测结果(图4e)。
夹心ELISA的优点是其对分析物检测具有更高的特异性。捕获抗体固定样品中的特异性抗原,因此样品不需要事先纯化,这与直接和间接ELISA不同。通过使用两个抗体“识别”步骤,抗原被有效地夹在捕获抗体和检测抗体之间。夹心ELISA的主要缺点是必须使用特定的捕获抗体和检测抗体。捕获抗体和检测抗体与抗原上的不同表位结合,必须提前进行验证以防止对抗原结合位点的竞争。同时,夹心ELISA也比直接和间接ELISA更耗时。
竞争ELISA不同于直接ELISA、间接ELISA和夹心ELISA,它使用竞争性结合过程。将一抗与未纯化的样品一起孵育(图4a),与样品中存在的抗原结合(图4b)。样本中存在的抗原越多,形成的抗原-抗体复合物就越多。将抗原-抗体复合物加入到预先包被抗原的96孔板中,未结合的抗体与孔中的抗原结合(图4c)。形成的抗原-抗体复合物越多,可用于结合孔中抗原的抗体就越少,即在样品中的抗原和孔中预包被的抗原之间存在抗体的竞争。将孔板孵育一定时间,然后用磷酸盐缓冲液洗涤除去未结合的抗体,并加入封闭缓冲液(图4d)。加入与酶偶联的二抗(图4e)。最后,加入底物并使用酶标仪检测颜色变化(图4f)。
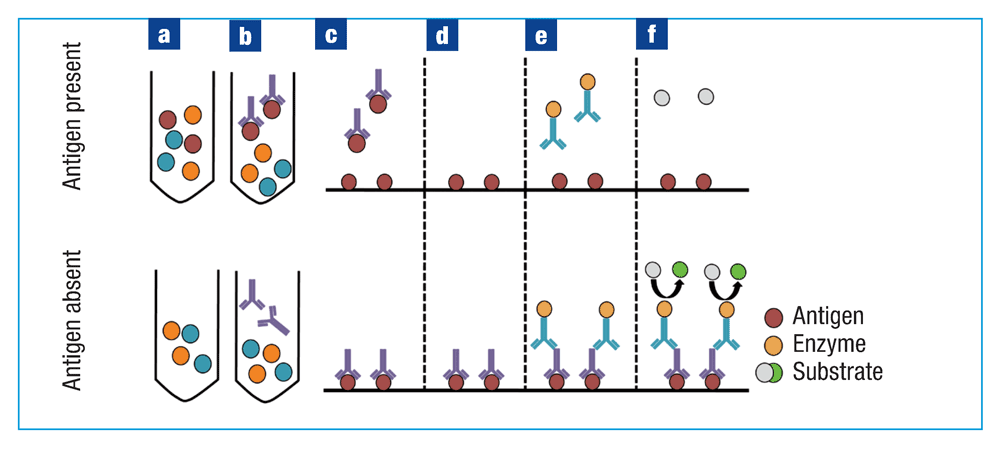
图4 竞争ELISA
竞争ELISA的标准曲线与其他类型ELISA曲线相反,样品中高含量的抗原产生较低的信号。竞争ELISA适用于未纯化的样品,通常只需离心去除微粒即可,并且比夹心ELISA的检测范围更宽。竞争ELISA通常用于检测不具有多个抗原表位的小分子。竞争ELISA的特异性较低,不应用于稀释样品(通常可使用夹心ELISA)。
| 类型 | 优点 | 缺点 |
|---|---|---|
| 直接ELISA |
|
|
| 间接ELISA |
|
|
| 夹心ELISA |
|
|
| 竞争ELISA |
|
|
| 问题 | 可能原因 | 解决方法 |
|---|---|---|
| 低信号(样品和标准曲线) | 使用旧孔板或久置试剂 | 准备新孔板/新配试剂(检查pH值),并适当储存 |
| 洗板过猛 | 用轻轻吸取缓冲液洗板 | |
| 孔变干 | 使用带有密封膜的孔板,或使用封口膜覆盖 | |
| 酶反应不充分 | 优化显影温度和时间 | |
| 检测波长不正确 | 检查酶标仪上的过滤器和软件 | |
| 低信号(仅样本) | 低于检测下线 | 降低稀释系数或浓缩样品 |
| 不兼容的样本类型 | 使用阳性对照确保兼容性 | |
| 低/较差信号(仅标准曲线) | 标准品未正确复溶或储存 | 重新配制新标准品,储存于-70ºC |
| 标准品添加错误 | 检查是否存在移液错误 | |
| 标准品稀释/配制错误 | 检查标准品的配制 | |
| 阴性对照的阳性结果 | 样品污染 | 使用新配试剂/正确使用移液器 |
| 洗涤不充分 | 增加洗涤步骤 | |
| 检测抗体与捕获抗体相互作用(夹心ELISA) | 确保抗体不发生交叉反应 | |
| 高背景 | 背景孔被污染 | 小心移液,使用多通道移液器 |
| 洗涤不充分 | 增加洗涤步骤 | |
| 高信号 | 样本含有高于测定范围的抗原 | 稀释样品 |
| 洗涤不充分 | 增加洗涤步骤 | |
| 过饱和样品 | 减少孵育时间或温度 | |
| 变异系数(CV)高 | 孔板中存在气泡 | 读数前确保无气泡 |
| 移液量不一致 | 使用校准的移液器,小心移液 | |
| 边缘效应(即边缘附近的信号在统计上不同于中心孔) | 确保孔板上各个孔具有相同的温度和湿度 | |
| 样本不均匀 | 移液前彻底混合样品 | |
| 堆叠孔板 | 切勿堆叠孔板 |

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved