
侧向层析检测(LFA)作为纸基POC诊断领域的一种成熟策略,是最便宜、最快速且最容易使用的纸基检测,可用于现场分析/定量各种不同生物样本(包括血液、尿液、唾液和许多其他类型)中生物标志物(如蛋白质、小分子、核酸等)。LFA广泛应用于生物医学、食品污染物和有毒化学品的检测以及环境监测中。
传统商业用途的LFA存在一些局限性,包括灵敏度与实验室检测的相比较差(假阴性更多)以及特异性较低(假阳性更多)(图1A)。这些限制也阻碍了SARS-CoV-2、流感、链球菌和HIV通过LFA进行检测,维持了采用更复杂的实验室检查(如PCR、ELISA)进行诊断的要求。例如,即使有商业SARS-CoV-2 LFA,其临床检测准确性(阳性预测值:11%~50%)远低于声称的87%~97.5%的灵敏度和100%的特异性,这限制了LFA对大规模流行病的控制和管理。
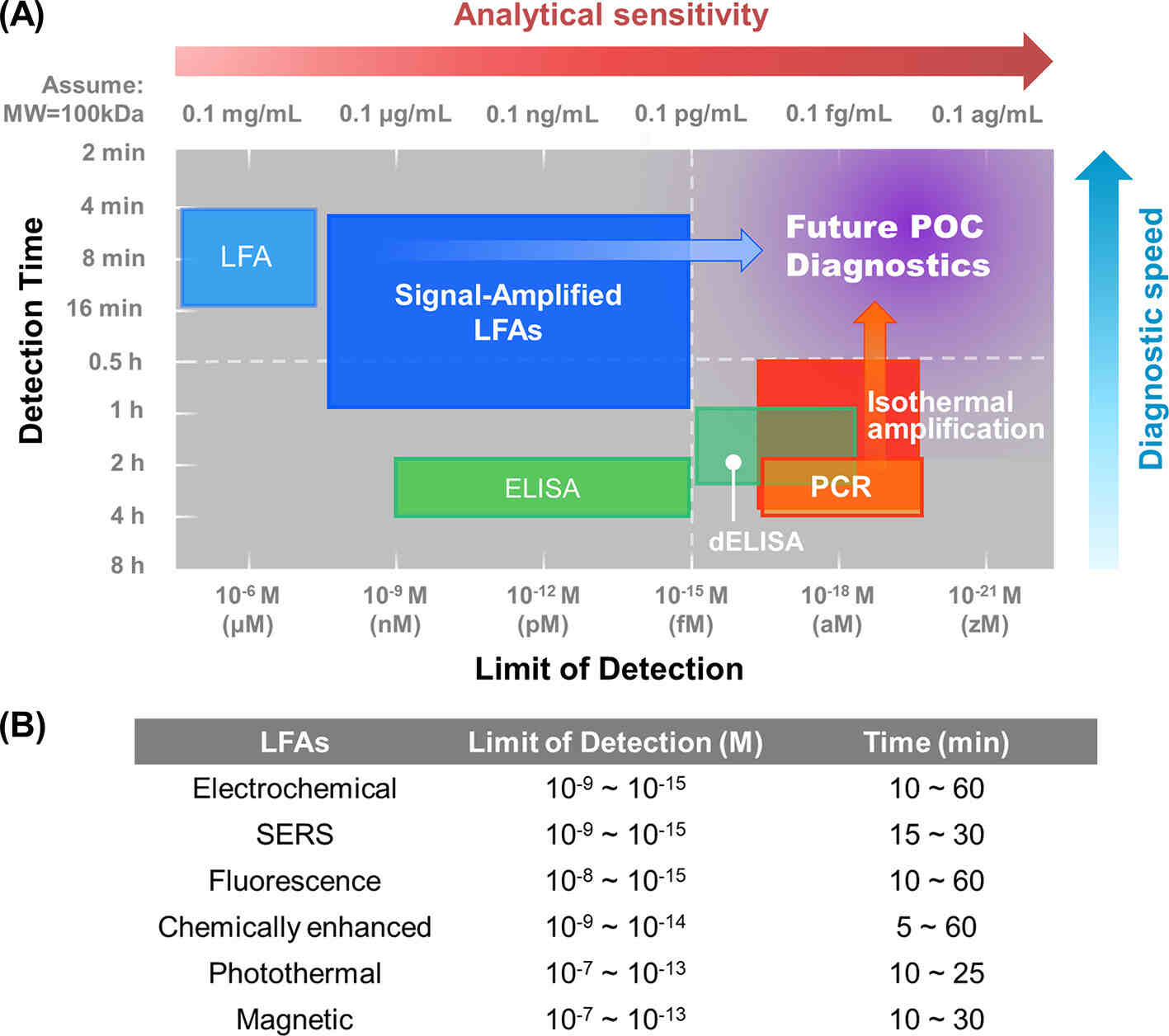
图1 信号增强LFA与其他诊断工具的分析灵敏度和诊断速度的比较
为了解决这些限制,人们投入了大量精力来提高LFA的灵敏度和特异性,以实现更准确和更高性能的POC测试。提高灵敏度的两种重要策略包括检测方法改进和样本富集。如信号增强LFA可以将检测灵敏度提高几个数量级,使LFA能达到ELISA级别的灵敏度。此外,进行样本预富集,并配合读数系统可提供PCR级灵敏度。虽然灵敏度提高了,这些技术往往需要更长的检测时间。因此,平衡灵敏度和检测时间对未来POC诊断的开发构成了重大挑战。LFA的特异性也很重要,主要通过分析优化、鉴定和使用高亲和力和高特异性试剂来提高。图2描述了夹心LFA结构以及用于提高LFA灵敏度和特异性的样本富集、分析优化和信号增强方法。
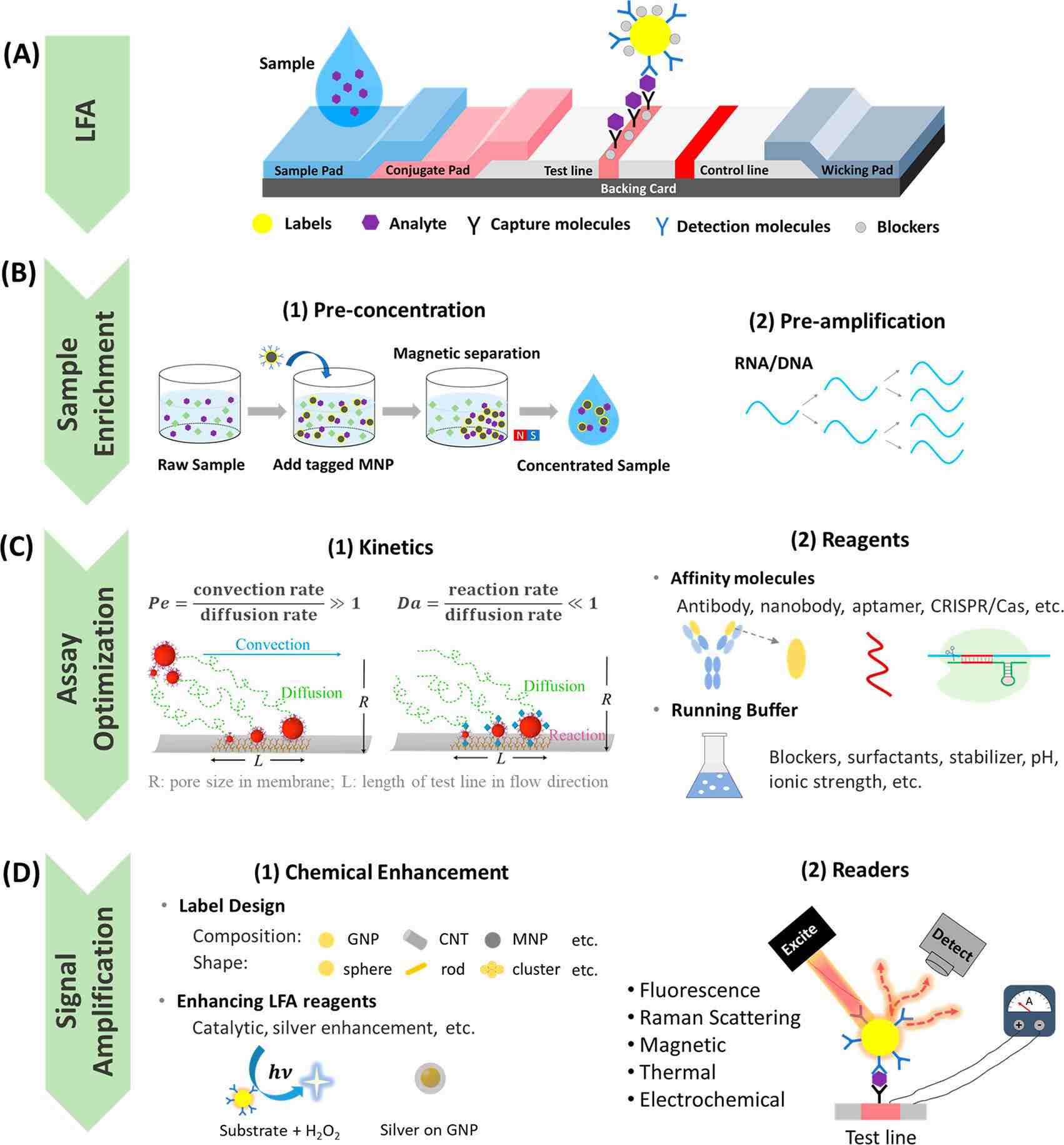
图2 提高LFA灵敏度和特异性的策略
了解检测动力学是LFA开发的基本步骤,对于提高LFA灵敏度至关重要。这最终影响特异性结合(SB)和非特异性结合(NSB),进而决定检测的灵敏度和特异性。因此,优化分析动力学的目标是最大化SB和最小化NSB,可以通过最大化信噪比(SB/NSB)来实现定量分析优化。
传输动力学和反应动力学分别用佩克莱特数(Pe)和达姆科勒数(Da)来表征,它们定义分别为:

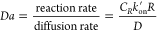
其中:
U是移动流体通过LFA膜的速度,R是膜内孔隙的特征大小,D是流体中运输的分子和结合标记的扩散率;CR是测试区域中捕获分子的浓度 ,Kon′是测试区域中偶联标记的有效正向免疫反应速率常数,假设Kon′=nKon,其中kon是单个抗体-抗原免疫反应的正向反应速率常数,n是每个标记颗粒的有效抗原数。
表1 LFA中Pe和Da的估计值
| 参数 | 估计值范围 |
|---|---|
| 膜的特征孔径 L(m) | (3-20)×10–6 |
| 平均流体流速 U(ms–1) | (0.5–3)×10–4 |
| 扩散率 D(m2s–1) | 10–12–10–10 |
| 结合速率常数kon′(M–1s–1) | 103–105 |
| 捕获抗体浓度CR(mol m–2) | 10–10–10–8 |
| 佩克莱特数Pe | 10–102(≥1diffusion limit) |
| 达姆科勒数Da | 10–4–10–1(≤1reaction limit) |
根据表1中的Pe和Da估计值,LFA受反应速率限制,提高反应效率是实现SB最大化和提高LFA灵敏度的最关键步骤。分子和标记物的传输受扩散速率的限制(≤对流速率,Pe=10–102),表面反应受反应速率的限制(≤扩散速率,Da=10–4–10–1)。反应效率的提高可以通过提高反应速率来实现,反应速率与反应速率常数(反应动力学)和反应物浓度成正比,和/或通过增加反应时间来实现。
针对夹心法检测,增加偶联物/抗原/捕获抗体三元反应动力学:当抗原首先与偶联标记物结合,然后在预混合流中与捕获抗体结合时,夹心三元形成的速度比它首先与捕获抗体结合,之后在顺序流中与偶联标记结合时慢。顺序流的检测限(LoD)值比预混合流的低4到10倍。而顺序流的缺点在于较长的检测时间。
对于核酸杂交,杂交动力学与盐浓度低于0.2 M时的离子强度密切相关。在测试区域前的膜中添加盐水屏障以加速杂交反应,在不改变LFA形式和程序的情况下,检测灵敏度可以提高10倍。这也会减慢流速,增加检测时间。
对于抗原和抗体之间的大多数免疫反应,反应速率常数相对不变。提高反应物浓度可能是提高反应速率,增加测试区域中捕获标记物数量的有效替代方法。因此,在将样本引入侧向层析测试之前,可以将样本中的分析物进行预浓缩(图2B(1))。如有研究人员在侧向层析之前,同时使用磁性分离对样本中的分析物进行预浓缩,灵敏度提高了10倍。有研究称,通过在样本中加入非离子表面活性剂TritonX-114以形成两相胶束系统,可以将预标记的分析物预浓缩到无胶束层中,该方法可将LoD提高约10倍。
其次,分析物也可以在LFA的流动周期内浓缩。例如,等速电泳有助于预浓缩抗原偶联复合物并增强LFA中的传输动力学,标记物的表面反应速率和平衡结合显著增加,LoD提高了400倍。
第三,增加偶联标记的有效结合位点的数量可以提高反应速率,从而降低LoD值。可以通过标记设计或检测分子的特定定向来实现结合位点的增加。例如,可以增加金纳米颗粒(GNP)大小,或者可以通过颗粒表面多层功能化,加载更多检测分子,从而增加结合位点的数量。值得注意的是,颗粒大小和涂层受到保持颗粒在流经多孔膜的过程中的稳定性和扩散率的限制;否则,可能会因沉淀和/或NSB而产生染色或背景噪音。与通过传统物理吸附的随机定向偶联相比,通过改进的偶联方法使检测分子在标记表面的特定定向可以产生更有效的结合。可以通过化学层介导的共价结合(如聚乙二醇化)或生物分子层介导的生物亲和结合(如protein A和protein G、生物素-链霉亲和素偶联、DNA介导的固定)来实现特异性定向。此外,应优化检测分子的覆盖范围,以最大限度地减少密集的检测分子层产生的任何位阻,并最大限度地提高对分析物的亲和力。
第四,可以增加测试区域中有效结合位点的数量。如测试线上常规捕获分子可以用3D“蛋白”探针代替,其中多个肽段是自组装定向的,增强了反应性,从而将灵敏度提高4到8倍。用纤维素纳米纤维修饰膜以加载更多捕获分子也可以将检测灵敏度提高20倍。据报道,纤维素纳米纤维使捕获分子更接近表面,从而将捕获标记的比色强度提高了36.5%。
增加反应时间可以增加测试区域中捕获的标签数量。例如将棉线放入膜中可以减慢流速,将检测灵敏度提高4倍。在膜和偶联垫之间添加堆积垫也能延长反应时间,将LoD提高1.1至2倍。
除了通过上述方法最大化SB外,最小化NSB对于提高LFA的灵敏度也很重要,因为NSB会干扰极低浓度分析物的检测,并限制灵敏度的提高。例如,40nm金纳米球(GNS)的聚乙二醇化可以减少不稳定的柠檬酸盐和稳定的NGS的聚集,帮助NSB大幅降低,从而提升检测灵敏度。同样,在金纳米颗粒上加入二氧化硅涂层,通过赋予颗粒高稳定性显著降低背景噪声。这种涂层还增加了颗粒表面积,从而能够加载更多抗体。结果表明,二氧化硅包被的GNP提高LoD30倍。综上,标记优化后的LFA灵敏度比传统的裸GNP标签高10倍。
总之,优化检测动力学是改进LFA的常用方法,LFA的灵敏度提升可多达百倍。
除了优化检测动力学外,放大测试区域的信号也可以普遍提高灵敏度。通过化学增强增加阳性测试区域的比色对比度是一种非常直接的方法,可以在保持目视检测便利性的同时增强信号。这种增强的对比度可以通过标签设计和使用增强LFA解决方案来实现。
标签设计法通常保持传统LFA形式,使用具有更强的比色对比度的标签取代传统小粒径(约20~40nm)GNS。如图2D(1)所示,可以通过优化GNP的结构和大小或使用粒子簇或由其他金属、金属氧化物或有机材料制成的颗粒替换GNP来实现更强的对比度。例如,GNP修饰的二氧化硅纳米棒标记(即包覆胶体金的微型二氧化硅纳米棒)在检测兔IgG时实现了比传统GNS LoD值低50倍。又如聚苯乙烯微珠用作纳米级GNS的载体以增强测试区域的比色对比度,将流感病毒H3亚型的检测灵敏度提高了64倍,比基于10nm GNP的LFA提高了16倍。使用碳纳米管(CNT)作为兔IgG检测的标记物,相比使用传统GNP检测限降低了3个数量级,这是由于CNT的更高纵横比,使得能够结合更多的检测抗体,提高了免疫反应速率。标记设计保留了LFA快速响应、使用简单和低成本的优势,无需改变任何检测形式或步骤。
LFA增强试剂可用于在正常测定后在测试区域诱导催化或其他化学反应,以放大比色对比度。催化反应通常是通过使用酶或纳米酶催化测试区域的氧化还原反应来实现的。使用最广泛的酶是辣根过氧化物酶(HRP)。在LFA中HRP与检测抗体耦连;上样后洗涤,去除膜上多余的标记物;HRP底物和H2O2溶液流经LFA催化,在测试区域产生强烈的显色反应或化学发光。有研究显示,通过酶促反应,检测灵敏度比传统基于GNP的LFA提高了1个数量级。
纳米酶是基于纳米材料的一类人工酶。与天然酶相比,纳米酶拥有更高的催化稳定性、更容易的修饰过程和更低的制造成本,近几年迅速发展为天然酶的直接替代物。一些纳米酶已经被用作LFA的标记物。如Pt纳米催化剂(Au@Pt core@shell结构)的使用实现了血清中p24蛋白LoD低至0.8 pg/mL,甚至优于商业ELISA的灵敏度(>1pg/mL)。
其他化学增强技术包括银增强、双金共轭和诱导金聚集。在银增强方法中,在常规测定后,通过将Ag还原剂流经LFA,Ag在测试区域中捕获的GNP上成核。GNP标签表面上生成的Ag层放大了测试区域的显色强度,灵敏度提高了约10倍。同样,双金共轭引入次级GNP与测试区域内已经捕获的初级GNP结合,从而增强显色强度。这种结合可以通过利用高生物素-链霉亲和素结合亲和力或者一抗和二抗之间的反应来实现,与间接ELISA的原理类似。诱导金聚集方法类似于双金共轭方法,但该方法可以在捕获的GNP上涂覆更多的GNP,从而更好地放大显色强度。大的聚集体运输速度较慢,因此需要的检测时间更长。值得注意的是,尽管这些方法提高了灵敏度,但由于偶联了多个反应步骤产生了不一致性,会降低量化信号(即最初捕获的标记)的能力。
除了化学增强方法外,LFA信号还可以通过使用检测仪进行放大。使用检测仪,测试区域中捕获的纳米颗粒(NP)标记被外部物理刺激(如激光、电势或磁场)激发(图2D(2)),以产生放大信号。使用光学/电/磁传感器检测相应信号可以识别背景上的微小信号差异。检测仪系统可以将检测灵敏度提高到传统的视觉读数几个数量级,可与ELISA的灵敏度媲美。此外,信号的定量(即标记量)可以通过微孔检测系统实现,因为信号强度通常与测试区域中捕获的NP数量成正比,这也与目标分析物的数量相关。根据激发方法,有多种类型的检测仪可供选择,包括荧光、表面增强拉曼技术(SERS)/光热法(即热对比度、光声成像/光热激光散斑成像/和热光子锁相成像)、电化学和磁放大。
以上方案在灵敏度优化上取得了实质性的进展,但仍需要综合分析,以减少同一技术内的性能差异。优化后的LFA灵敏度比传统商业LFA高1~9个数量级,基本可以达到ELISA的灵敏度(图1A)。部分技术的灵敏度,如荧光LFA和纸质电化学诊断,甚至可以达到fM水平(ELISA灵敏度的下限)。同时,我们需要注意的是,同一技术的LoD存在很大差异(3~6个数量级),这种差异是由于分析优化不足造成的。在检测过程中,NSB不可避免地与SB共存。当进行信号放大时,信号(来自SB)和噪声(来自NSB)都被放大;因此,假阴的数量减少了,但假阳的数量可能增加。换句话说,灵敏度的提高是以牺牲特异性为代价的。特别是对于低靶标浓度,NSB捕获的标记量可能与SB捕获的标记量相当,甚至更大。在这种情况下,进一步增加外部激励场的强度无法区分信号和噪声,而会产生假阳。因此,信号放大的效果可能会受到标记物NSB的限制。
为了解决这一限制,需要一种与信号放大技术兼容的综合分析优化方法(见图3)以降低NSB。经过这种优化后,可以使用更强的外加场或增强LFA试剂来进一步提高检测灵敏度,直到特异性受到影响(即假阳性的数量增加)。这种信号放大和分析优化的方法可以多次迭加进行,直到获得满意的灵敏度和特异性。
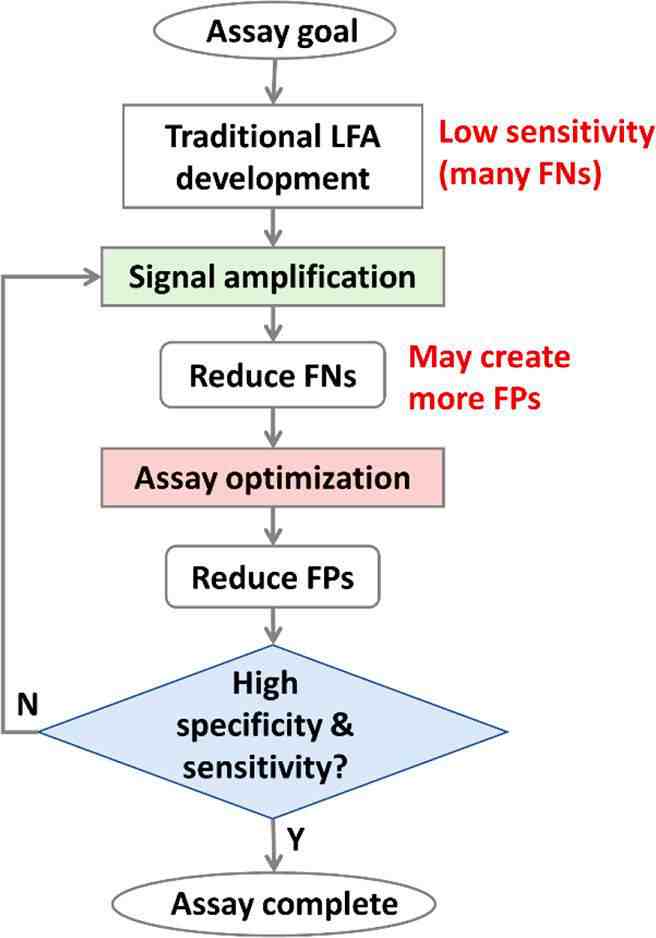
图3 结合信号放大方法进行综合分析优化
除了灵敏度之外,检测速度、易用性和成本也是评估POC诊断应用技术的重要指标。表2总结了LFA的优缺点和未来必要的改进,图1B显示了它们的检测时间的详细比较。如表2所示,化学增强保持了快速视觉检测的优势。相比之下,使用增强型LFA试剂会显著增加检测时间、检测复杂性和不精确性,因为需要额外的步骤来递送各种试剂。检测时间跨度从20分钟至1小时不等。为了解决检测时间增加的问题,研究人员试图通过设计一些LFA装置来实现多溶液自动化递送。同时,可以通过实现装置小型化,自动化所有检测步骤以及通过探索反应动力学来缩短检测时间。
表2 LFA的优点、缺点和未来改进的方向
| 信号放大 | 优点 | 缺点 | 未来改进的方向 |
|---|---|---|---|
| 化学增强 | 提高灵敏度 | 提高NSB | 自动化/小型化/操作简易化 |
| 快速读数 | 大标签的扩散问题 | 综合分析优化 | |
| 增加时间和复杂性 | 检测多种分析物 | ||
| 可能无法量化 | 多方法连用 | ||
| 创新的信号处理方法 | |||
| 检测仪 | 提高灵敏度 | 提高NSB | 临床验证 |
| 指标量化 | 增加了步骤和时间 | 小型化 | |
| 高重复性 | 增加成本 | 成本控制 | |
| 结构复杂(电化学) | 综合分析优化 | ||
| 检测多种分析物 | |||
| 多方法连用 | |||
| 创新的信号处理方法 |
同样,使用检测仪也会增加检测时间和分析成本。大多数检测仪的检测时间通常在20分钟以内,电化学法通常在30分钟以内,但是一些多步骤的测定可能需要1小时以上。研究人员做了诸多努力来减少检测仪的扫描时间。例如,最快的SERS检测仪可以在5秒内扫描一个测试区域,并且正在开发扫描时间<1分钟的热敏电阻检测仪。检测仪性能的可靠性和可重复性也仍然值得探究。未来需要进一步开展小型化、降低成本和临床验证工作,以使这些检测仪更适合POC应用。
此外,由于可以降低成本、样本量需求较小以及能够快速区分具有相似症状的常见疾病等优势,研究人员开始转向开发能够同时检测多种分析物的多重LFA。多重LFA存在一些挑战:包括交叉反应性、LFA试纸多重测试区域的物理限制以及临床验证存在困难。
最后,可以使LFA实现亚飞摩尔级检测灵敏度的新的信号处理方法已经出现。LFA信号通常以模拟信号形式读取,这本质上限制了灵敏度提高的上限,即检测仪需要累积数百万个标签才能产生可检测的信号强度,这很难实现类似于ELISA亚飞摩尔级灵敏度。相比之下,数字ELISA(dELISA)采用数字信号的采集方法,可以计数免疫反应后每个酶标信号,检测到亚飞摩尔级至渺摩尔级浓度。然而这些平台尚未准备好用于POC,其制造和使用的复杂性或信号处理所需的周转时间很长。尽管如此,考虑将dELISA的信号采集方法与现有的LFA相结合,开发一种更便宜、更简单的数字检测平台用于超灵敏POC诊断是有价值的。综上,经过分析优化、设备升级和验证,以上方法有望适应未来的超灵敏POC应用。
参考文献
Liu Yilin, Zhan Li, Qin Zhenpeng, et al. Ultrasensitive and Highly Specific Lateral Flow Assays for Point-of-Care Diagnosis[J].ACS Nano 2021 15 (3), 3593-3611.DOI: 10.1021/acsnano.0c10035.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved