
生物制品特别是治疗性抗体药物的免疫原性是临床前和临床研究中需要解决的重要问题,它可能导致疗效损失、药物暴露变化甚至严重副作用,且使得毒性、药代动力学(PK)和药效学(PD)数据的解释复杂化。一般通过检测和定量抗药抗体(ADA)来评价生物制品的免疫原性,检测方法主要有直接法和桥连法。直接法中使用药物捕获ADA后加入种属特异性的抗体进行检测,直接法的限制在于存在种属特异性,且无法检测所有同种型的ADA。桥连法中使用药物捕获ADA后加入标记的药物,对形成的药物-ADA-药物复合物进行检测。桥连法不受种属限制,可检测所有同种型的ADA(如IgM和IgG),及除IgG4外大部分亚型而应用更广。但是,桥连法检测ADA易受多种因素影响,血液循环中可溶性靶点是常见的干扰因素之一。可溶性靶点会引起假阳性或假阴性结果,进而影响药物免疫原性风险的评估,因此开发可降低可溶性靶点干扰的ADA检测方法非常关键。
由于疾病导致的生理差异,在血液中可能存在从细胞膜表面脱落的靶点受体、因细胞裂解而释放的胞内靶点等可溶性靶点。可溶性靶点产生影响主要包括:(1)给药前体内高浓度的可溶性靶点可能干扰ADA检测、与真实药前数据偏离及对药物免疫原性风险的判断;(2)个体间可溶性靶点浓度不同,检测结果药前ADA个体差异大,不利于临界值的确定;(3)在某些情况下,虽给药前较低的可溶性靶点浓度不会影响ADA检测,但给药后靶点受体从细胞膜脱离水平增加、内在负反馈机制导致可溶性靶点分泌增多、靶点分子与药物结合导致清除减慢和浓度增加等原因亦可能干扰ADA检测。
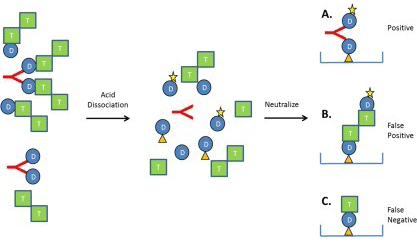
可溶性靶点对ADA检测的影响
图中“D”表示抗体药物、“T”表示药物靶点和红色“Y”形符号表示ADA。酸解离后,药物-靶点和药物-ADA复合物被破坏。(a)在没有干扰的情况下,捕获药物(橙色三角形&“D”)、ADA和标记的药物之间形成桥连。(b)如果药物靶点是多聚体(如双“T”分子),则在没有ADA的情况下也可能会形成桥连,从而导致假阳性结果。(c)如果药物靶点是单体,并且在干扰ADA结合的结构域以高亲和力结合捕获药物,则药物靶点可导致假阴性检测信号。
不同试验条件下,可溶性靶点的物理化学特征及其与药物的相互作用、亲和力大小决定了对ADA检测干扰程度。基质中可溶性靶点形成的二聚体或多聚体直接与捕获试剂和检测试剂桥连而出现假阳性信号;而单体靶点分子与ADA竞争结合捕获试剂导致假阴性结果。此外,采用酸解离“药物-ADA”复合物的同时会释放与药物(如单抗、融合蛋白)结合的靶点分子,造成基质中的靶点浓度迅速升高(可达数量级改变,如机体接受靶向血管内皮生长因子的单抗或融合蛋白治疗时),反而可能会导致异常的假阳性或假阴性结果。
目前,常用于降低可溶性靶点干扰的方法包括多种。在方法开发过程中应仔细考虑并权衡每种策略的优缺点及可能存在的风险,选择易操作、效果显著、风险较小的策略;若单一策略无法满足需求,可尝试将多种策略结合以达到目的。
在筛选实验或确证实验中加入抗可溶性靶点的特异性抗体可降低游离靶分子的干扰。一般情况下,在观察到有可溶性靶点干扰后可首先尝试制备多个特异性抗体,通过实验设计以筛选出可减轻干扰、不影响ADA检测的抗体。该方法简单易操作,通量较高;若在方法学验证期间即采用该方法,可明显降低空白个体的背景值差异,有利于临界值的确定。去除血管生成素、血管内皮生长因子和细胞因子等干扰均可采用该方法。
若采用上述方法,抗可溶性靶点抗体设计需注意其结构序列应与药物骨架不同、或与药物不存在或较少存在同源性序列,否则会造成ADA与抗可溶性靶点抗体的交叉反应。在模拟真实样品情况确定检测方法后,一定要用此方法检测真正样品(临床前或临床),以评估是否会影响ADA检测。
考虑药物的作用机制,若药物通过与靶点结合而抑制靶点与其受体结合,可采用向基质中加入过量的可溶性受体以排除干扰。通常,靶点与其受体亲和力较高,因此加入受体可有效抑制可溶性靶点干扰。有研究表明,ADA检测实验中阳性信号值随加入受体浓度的升高而降低,但不能完全抑制可溶性靶点的影响;而引入弱酸性环境后,低浓度的受体即可完全抑制可溶性靶点的影响。去除抗IgE抗体ADA检测中IgE的干扰也可考虑加入IgE的受体。
这种方法可能出现的问题是,即使加入极其过量的可溶性受体也无法减轻干扰。造成以上情况的原因可能有以下几点:(1)受体的制备技术限制,体外无法生产出和天然受体完全相同的重组受体,导致无法和可溶性靶点有效结合。如天然受体在细胞表面表达,体外生产的重组可溶性胞外区结构可能与其天然结构不同;(2)药物与靶点的亲和力极高,靶点很难与可能低亲和力的可溶性受体结合。除此之外,还应结合受体生产量是否可满足样品检测的需求、受体生产的成本进行考虑采用此方法的必要性。
若不能获得满足要求的针对可溶性靶点的抗体或受体,可尝试将样品中的ADA预先从基质中分离纯化出来,再用于检测。此方法预处理过程可能导致ADA部分丢失,且增加了样品预处理步骤,操作过程较为复杂,试验通量较小。此外,可能需特殊的仪器及耗材。
酸化-磁珠提取(bead extraction and acid dissociation,BEAD)法可较好分离ADA。其主要通过样品进行酸化处理释放所有ADA后加入大量含生物素标记的药物捕获ADA达到目的。BEAD法不仅可有效降低可溶性靶点及基质中其他物质的干扰,也可提高方法的灵敏度和药物耐受程度。但由于多次引入酸化步骤,可能导致ADA降解、结构改变或ADA分离不完全,使ADA检测信号值低于真实值。因此,在方法学开发阶段需确认该法对于ADA检测无影响后,再用于样本检测。
先经过亲和捕获ADA,然后采用桥连接法进行分析,即将样品与加入生物素标记的药物在包被链霉亲和素板上过夜孵育,随后经酸化处理将捕获的ADA解离后进行桥连试验检测也可有效减弱可溶性靶点的干扰。
除了从样品中分离ADA,还可通过固相提取去除可溶性靶点以消除干扰。其基本原理是将样本与包被了特异性结合可溶性靶点的单抗或配体的磁珠或板共孵育后,离心去除磁珠或从板吸出溶液即可去除可溶性靶点。
凝集素可特异性地结合糖基化复合物的糖基,因此加凝集素后能抑制糖基化可溶性靶点造成的ADA检测干扰。、需注意的是,由于凝集素可与人免疫球蛋白的糖基结合,需评估加入凝集素是否会同时干扰真实的ADA检测。
若抗体药物的Fc结构域含Pro329Gly修饰,可利用该修饰位点设计ADA检测方法,避免基质中可溶性靶点和过量药物的干扰。加入过量药物,使基质中全部游离的ADA与药物形成复合物;随后采用生物素标记的抗Pro329Gly的抗体捕获ADA-药物复合物;加地高辛标记的hsFcγRI进行检测。
与常规桥连试验相比,该法可特异性地检测ADA,有效避免可溶性靶点的干扰;对于天然抗体的检测灵敏度较好,有利于评估给药后的ADA产生。但该法需对抗体Fc进行Pro329Gly修饰,仅能检测IgG1抗体,不能检测其余ADA亚型,因此适用范围极小。
可溶性靶点的存在会影响药物ADA的检测及结果判断,进一步影响对药物药动学、有效性及安全性的评估。可溶性靶点对生物制品ADA检测的干扰受多种因素影响,包括药物及靶点的物理化学特点、药物与靶点的相互作用、药物的作用机制、选择的实验方法等。开发可减轻可溶性靶点干扰的分析方法非常重要,也颇具挑战。基于风险评估,在ADA方法开发初期,应根据药物的作用机制、靶点的生物学特点、给药后的生理代偿等提前评估相关可溶性靶点对检测的可能干扰。若可溶性靶点干扰大,应充分参考靶点及药物作用特性,尝试多种方法,以选择最方便经济可靠的方法去除可溶性靶点干扰,同时不影响真实ADA检测。在选择特定方法后,应用真实样本检测以进行进一步佐证。需注意的是相同靶点的药物,可溶性靶点对检测的影响也是有差异的,应经完全评估后才能应用于新药物的ADA检测。
参考文献
[1]GUNN G R, SEALEY D C F, JAMALI F, et al. From the bench to clinical practice: understanding the challenges and uncertainties in immunogenicity testing for biopharmaceuticals[J]. Clinical and Experimental Immunology, 184(2), 2016, 137–146.
[2]SHAO X, LUO WJ, WANG HX, et al. Challenges and strategies for anti-drug antibodies detection by bridging assay of biological products with soluble targets[J]. 33(11), 2019, 1007-1012.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved