
T细胞受体(T cell receptor, TCR)是适应性免疫系统中识别抗原的核心分子。与抗体类似,TCR能够通过高度特异性的方式识别抗原,但不同之处在于TCR只能在主要组织相容性复合体(major histocompatibility complex, MHC)分子呈递的背景下识别展示在机体自身细胞表面的抗原。正是这种“肽–MHC”复合物(pMHC)的特异性识别,使得TCR在清除病毒感染、肿瘤免疫监视以及免疫耐受的建立过程中扮演不可替代的角色。
本文将介绍TCR是如何通过独特的结构基础,实现对抗原的高特异性识别的。通过对分子结构的梳理,我们可以更好地理解TCR与抗原之间的相互作用机制,以及这些结构特征如何被应用于免疫治疗、疫苗设计和疾病诊断。
TCR是由通过二硫键连接的两条多肽链组成的细胞表面异二聚体。根据链的组合类型,TCR可分为两类:αβ-TCR,是大多数T细胞识别抗原的受体,主要识别由经典MHC I类分子(如HLA-A/B/C)或MHC II类分子(如HLA-DR/DP/DQ)提呈的抗原肽;γδ-TCR,可直接识别非肽类抗原(如磷酸化代谢中间产物、脂质)或应激分子,无需MHC分子提呈,具有更广谱的抗原识别能力。
TCR在结构域组织和结合模式上与抗体Fab片段具有相似性,每条TCR链均由可变区(variable region, V)和恒定区(constant region, C)的Ig样结构域、跨膜区及短胞质尾区组成。
在可变区中,最关键的部分是互补决定区(complementarity-determining region, CDR)。αβ-TCR通过其CDR与pMHC复合物结合,其中CDR1和CDR2主要来源于种系V基因片段,通常与MHC分子接触;而CDR3则由V(D)J重排过程中产生的多样性序列构成,是与抗原肽直接相互作用的主要区域。
在跨膜区及胞内区域,TCR自身的胞内尾巴极短,无法直接进行信号转导,因此与CD3复合物共同组装,形成完整的信号复合体。跨膜域通过带电氨基酸与CD3形成稳定相互作用,而信号转导则依赖于CD3分子内含的免疫受体酪氨酸活化基序(ITAM)。当TCR识别到抗原肽–MHC复合物后,这些ITAM会被Src家族激酶磷酸化,从而启动下游的T细胞激活级联反应。
总体而言,TCR的结构设计可以概括为“三段式”分工:可变区负责识别,恒定区提供稳定支架,跨膜区和胞内复合物负责信号转导。正是这种结构上的层层配合,使得TCR在保证特异性识别的同时,还能迅速转化为细胞内的信号,从而触发免疫效应。
TCR的核心功能在于其对抗原肽–主要组织相容性复合物(pMHC)的特异性识别。MHC I类分子通常呈递来源于细胞内蛋白降解的肽段,主要被CD8⁺细胞毒性T细胞识别;MHC II类分子则主要呈递细胞外摄取的肽段,由CD4⁺辅助性T细胞识别。这种分工使得免疫系统能够覆盖病毒感染、肿瘤突变和外源病原体等不同来源的威胁。
在TCR–pMHC的对接模式(docking mode)上,研究表明大多数αβ-TCR与pMHC之间呈现相对固定的倾斜角度,称之为对角线结合模式(Diagonal docking mode)。其特点是TCR以一定角度覆盖pMHC结合槽的长轴上。在该模式下,TCR的CDR1与CDR2主要与MHC分子的α螺旋结构形成接触,而CDR3则深入抗原肽的核心区域,决定结合的特异性和多样性。这种结合模式保证了TCR对MHC框架的限制性识别,同时通过可变的CDR3区域与抗原肽直接接触,形成高度特异性的识别界面。虽然存在一定的例外情况,但这种“对角线”结合模式在结构研究中被反复观察到。
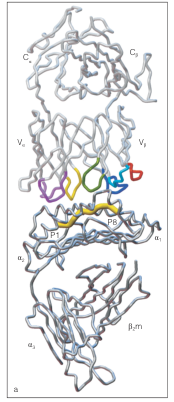
图1 TCR β链的CDR1、CDR2和CDR3环分别为浅蓝色、深蓝色和绿色;α链的CDR1、CDR2和CDR3环分别为浅紫色、深紫色和黄色。β链HV4环为红色。黄粗线P1-P8是结合肽。
结构证据来自经典的X射线晶体学研究。例如,Garcia等人在1996年解析了第一个人类TCR–pMHC复合物的晶体结构,揭示了CDR1、CDR2环与MHC分子α螺旋的相互作用模式,以及CDR3环深入结合抗原肽的关键作用。随后Rudolph等人的工作进一步总结了不同TCR–pMHC复合物的结构共性与差异,强调了TCR在兼顾MHC限制性与抗原多样性方面的分子基础。这些发现奠定了我们今天对TCR抗原识别机制的理解。
虽然TCR可与pMHC复合物形成高度特异性的结合,但其胞内区极短,无法直接介导信号转导。TCR的信号功能完全依赖于CD3复合物的参与。CD3复合物由CD3γε、CD3δε以及CD3ζζ二聚体组成,含有多个免疫受体酪氨酸活化基序(ITAM),是信号放大的关键元件。
在跨膜区的分子互作上,TCR的α链和β链跨膜螺旋区域带有带电氨基酸残基,分别与CD3跨膜结构中的相反电荷残基形成静电互补。这种“电荷对”互作确保了TCR–CD3信号复合体的稳定组装,为后续信号传递奠定物理基础。
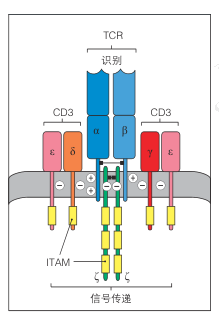
图2 TCR-CD3复合物结构示意图
当TCR识别到抗原并发生构象变化后,CD3ζ链上的ITAM序列会被Src家族激酶Lck磷酸化,从而启动下游的活化级联反应。ZAP-70(ζ-chain-associatedproteinkinase70)首先结合磷酸化的CD3ζ,继而激活并磷酸化适配蛋白LAT(linker for activation of T cells)。LAT作为信号平台,进一步招募Grb2、PLCγ1等分子,触发钙离子流入、MAPK通路和NFAT、NF-κB、AP-1等转录因子活化。最终,T细胞被全面激活,产生细胞因子、增殖并执行效应功能。
因此,TCR识别抗原不仅是一个分子识别事件,更是一个信号放大过程。从抗原肽–MHC结合到CD3复合物信号传递,再到下游转录因子驱动功能基因表达,这一完整流程确保了T细胞在面对病原或肿瘤时能迅速而精准地作出应答。
随着对TCR结构和功能认识的不断深入,TCR已从基础免疫学研究逐渐走向临床转化,其中最具代表性的应用就是TCR工程化T细胞疗法(TCR-T)。与CAR-T不同,TCR-T可以识别经MHC呈递的细胞内抗原肽,因此在肿瘤免疫治疗中具有独特优势。通过将针对特定肿瘤抗原的TCR基因导入患者的自体T细胞中,可以赋予这些细胞特异性识别并清除肿瘤的能力。早期临床试验显示,TCR-T在黑色素瘤、肉瘤和病毒相关肿瘤中已经展现了潜在疗效。
在免疫治疗靶点选择方面,TCR的特异性为靶向肿瘤新抗原提供了可能。肿瘤新抗原来源于肿瘤特异性突变,不存在于正常组织中,因而能够降低自身免疫相关副作用的风险。随着新抗原测序和生物信息学的发展,研究人员可以通过预测和验证候选新抗原,找到对应的抗原特异性TCR。这种新抗原–TCR配对的鉴定方式,为个体化治疗提供了新的策略。
同时,TCR测序在疗效评估和预测中的价值也日益受到重视。高通量测序技术能够全面描绘患者外周血或肿瘤浸润淋巴细胞中的TCR库多样性和克隆扩增情况。在免疫检查点抑制剂(ICI)治疗中,TCR克隆的扩增往往与持久的临床反应相关,而多样性下降则可能提示免疫副作用风险。因此,TCR测序不仅是科研工具,也有望成为临床决策支持和患者分层的重要方法。
TCR的研究历程充分表明,从分子结构解析到临床应用的转化路径是免疫学进步的重要驱动力。早期的结构研究揭示了TCR识别抗原的分子基础,为后续的功能研究和临床疗法开发奠定了理论框架。如今,TCR已成为免疫治疗研究的核心方向之一,不仅推动了TCR-T细胞疗法的发展,也在免疫治疗疗效预测、个体化医学和疫苗设计中展现出广阔前景。
尽管如此,TCR的特异性识别机制和交叉反应模式仍存在未解之处,不同免疫环境下的动态调控机制也尚需深入研究。要实现TCR在精准医学中的全面应用,需要结构生物学、计算免疫学和临床医学的持续合作。
总的来说,TCR的研究已经从基础免疫学走向临床转化,未来有望在肿瘤治疗、自身免疫病调控和感染性疾病防治中发挥更大作用。
参考文献
[1]Garcia KC, Degano M, Stanfield RL, et al. An αβ T cell receptor structure at 2.5 Å and its orientation in the TCR–MHC complex. Science. 1996;274(5285):209-219.
[2]Rudolph MG, Stanfield RL, Wilson IA. How TCRs bind MHCs, peptides, and coreceptors. Annu Rev Immunol. 2006;24:419-466.
[3]Zhang L, Xu X, Shi X, et al. T cell receptor signaling and cell immunotherapy. Natl Sci Open. 2024;3:20230087.
[4]Klebanoff CA, Chandran SS, Baker BM, et al. T cell receptor therapeutics: immunologic targeting of the intracellular cancer proteome. Nat Rev Drug Discov. 2023;22(12):996-1017.
[5]Huang AL, He YZ, Yang Y, et al. Exploring the potential of the TCR repertoire as a tumor biomarker. Oncol Lett. 2024;17(6):413.

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2026 All Rights Reserved