
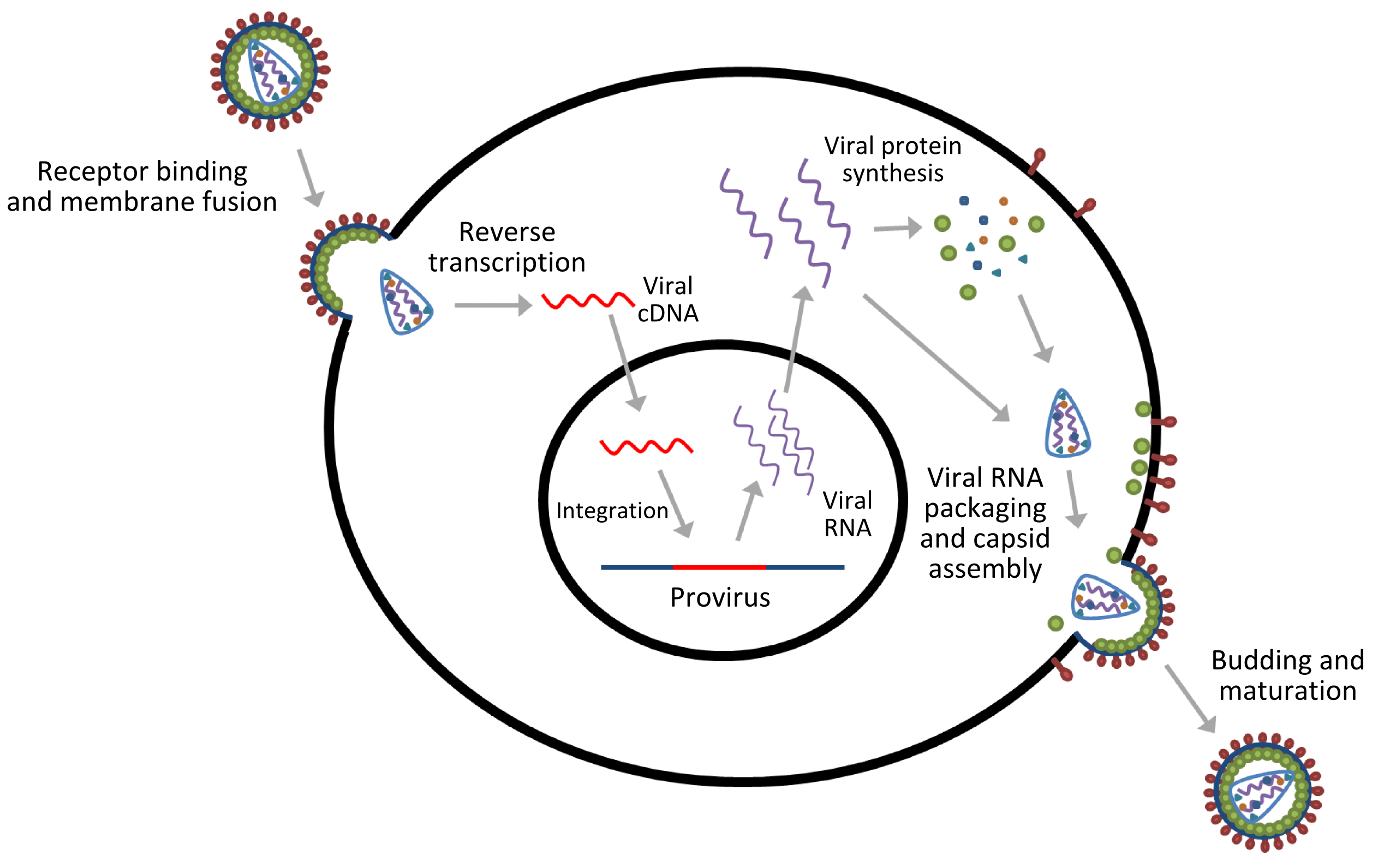
自利妥昔单抗以来,研究人员为打破B细胞淋巴瘤,包括非霍奇金淋巴瘤(NHL)的治疗限制,进行不断尝试与努力,探索了多种新型高效免疫疗法,其中一些已经成功上市。在过去的十年中,大量基于抗体的强效B细胞淋巴瘤疗法获得批准,这些疗法与CAR-T一起极大地改变了治疗格局。其主要形式包括TCE与ADC。
博纳吐单抗(Blinatumomab) 安进(Amgen)的Blinatumomab是一种CD19×CD3双特异性抗体,双向结合B细胞表面CD19与T细胞表面CD3,通过激活内源性T细胞,导致CD19阳性的B细胞来源的肿瘤细胞定向裂解。
莫妥珠单抗(Mosunetuzumab) 罗氏首个欧盟/FDA获批的CD20×CD3 TCE,分别靶向B细胞表面CD20与T细胞表面CD3,通过双重靶向激活和重定向T细胞,释放细胞毒性蛋白消灭目标B细胞。
艾可瑞妥单抗(Epcoritamab) 艾伯维和Genmab的Epcoritamab是皮下注射的靶向CD3×CD20的TCE,采用了DuoBody®平台技术 ,通过Fab臂交换制备,既保持了原始IgG1抗体结构,又延长了血浆半衰期。
格罗菲妥单抗(Glofitamab) 罗氏旗下的Glofitamab是一种新型T细胞重定向CD3×CD20双特异性抗体,具有独特的2∶1结构设计,含有2个靶向CD20的抗原结合区,一个靶向CD3的抗原结合区,双重靶向使T细胞更接近,从而实现有效的靶向杀伤。

维布妥昔单抗(Brentuximab vedotin, Seattle Genetics /Takeda) 由靶向CD30的单克隆抗体连接一种抑制微管的细胞毒药物(单甲基澳瑞他汀E,MMAE)组成。
泊洛妥珠单抗(Polatuzumab vedotin, Genentech) 由靶向CD79b的单克隆抗体偶联MMAE组成。
泰朗妥昔单抗(Loncastuximab tesirine, 瓴路药业/ADC Therapeutics) 由靶向CD19的人源化单克隆抗体与吡咯并苯并二氮杂卓(pyrrolobenzodiazepine,PBD)二聚体细胞毒素偶联而成。
未被满足的医疗需求不断启发新型抗体疗法出现,无论是在临床试验的早期或POC阶段还是后期阶段,似乎都有希望解决目前临床实践中出现的局限性。

IGM Biosciences的Imvotamab是靶向CD20×CD3 IgM同种型的TCE。它可以十价结合CD20,以期以更大的亲合力与CD20结合。临床前研究表明,它可能比IgG双特异性抗体具有优势,更有可能克服CD20低丰度或诱导损失的耐药性,并实现比目前批准的抗体疗法更大的耗竭。其1期临床试验产生的数据提供证据表明,Imvotamab在难治性或复发性NHL患者中表现出良好的安全性和耐受性,具有令人鼓舞的活性。了解更多

Odronextamab(Regeneron)是一种靶向CD20×CD3双特异性抗体。这种TCE采用在Fc引入IgG1/3局部同型嵌合的形式,并有望成为具有改进PK特性的天然形式。
Odronextamab报告了其关键的2期研究的新数据,目前正在接受FDA的优先审查。如果获得批准,Odronextamab将成为第一个也是唯一一个同时用于滤泡性淋巴瘤(FL)和弥漫大B细胞淋巴瘤(DLBCL)的双特异性抗体——这是NHL最常见的两种类型。了解更多
嘉和生物旗下GB261是一种CD3×CD20的双特异性抗体,是第一个对CD3具有超低亲和力并保持Fc功能(ADCC和CDC)的TCE。通过其设计的作用机制,Fc介导的细胞溶解和T细胞介导的杀伤作用在治疗初期到晚期的T/B细胞比例变化中占主导地位。
GB261通过体外测定和体内模型显著抑制利妥昔单抗耐药癌细胞的增长,T细胞激活的同时相较同类产品有较低的细胞因子释放。目前正处于临床试验阶段,有望成为治疗B细胞恶性肿瘤的高效TCE。了解更多


由CytomX与AbbVie合作开发的CX-2029使用靶向CD71的抗体前药(Antibody Prodrug, Probody)偶联MMAE。抗体前药在抗体的目标结合区连接一段掩蔽肽(masking peptide)以掩蔽目标活性区域,从而达到限制抗体在健康组织中被激活的作用。其活性将被肿瘤相关蛋白酶恢复,从而恢复靶点与肿瘤的结合,为这个之前无法成药的靶点创造一个治疗窗口。该前药在可耐受剂量下显示出临床活性,目前正在对部分实体瘤和DLBCL患者进行1/2期评估。了解更多
靶向上述抗原时,不但不能覆盖所有癌细胞,而且很难将恶性B细胞与非恶性B细胞区分开来,从而导致靶向毒性。CH2-aIgM-MMAE的惊人研究为NHL治疗提供了新的机制,它是一种靶向人源IgM的抗体前药ADC:(1)靶向人源IgM(恒定结构域),而不是CD标志物,以根除克隆性B细胞淋巴瘤。抗体来源于鸡而不是哺乳动物来获得所需的免疫反应。(2)鸡源性aIgM通过双肿瘤蛋白酶可裂解连接子,与含有表位的IgM CH2结构域融合掩盖结合位点。(3)前药偶联MMAE。(4)在条件蛋白酶介导的掩蔽肽水解作用下,前药的结合能力恢复,从而使靶向依赖性抗体内化,随后使诱导恶性B细胞凋亡成为可能。了解更多

随着医疗边界的不断突破,对临床实践的限制不断减少。未来,随着抗体疗法的不断发展,B细胞恶性肿瘤的治愈机会会进一步提高。
德泰生物单个B细胞抗体发现平台解锁由稀有物种产生的下一代抗体发现。我们正在研究鸡、绵羊、猪等案例,为您定制稀有物种生成的抗体。
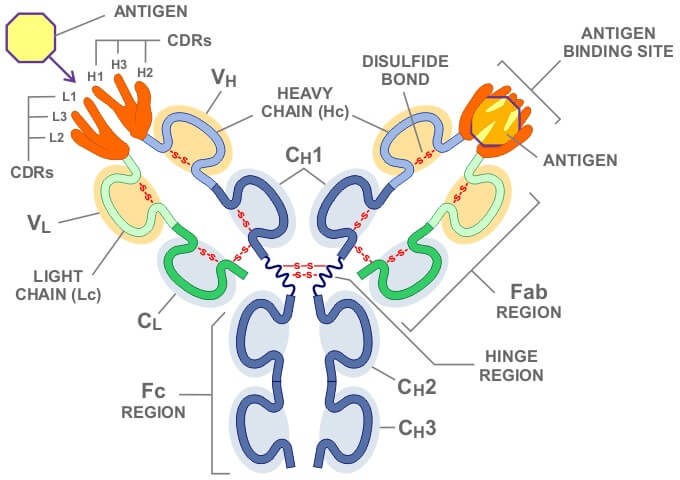
抗体是一种免疫球蛋白,由B淋巴细胞产生。抗体的单体是一个Y形的分子,有4条多肽链组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起。每条重链50kDa,每条轻链25kDa,轻重链间存在二硫键链接。
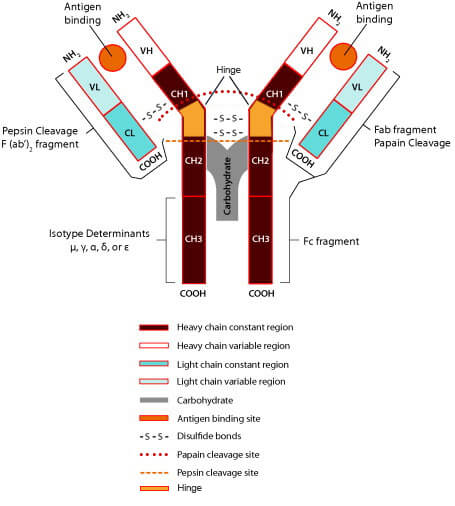
图1:抗体结构图
轻链包括可变区和恒定区,可变区约占轻链的1/2。
重链包括可变区和恒定区。根据重链的不同,可以将抗体分为不同的种类,例如哺乳动物 Ig 的重链有α、δ、ε、γ和 μ 五种,相对应可以将哺乳动物Ig分为 IgA、IgD、IgE、IgG 和 IgM 五类。
抗体分子的N端存在一段氨基酸序列变化较大的区域,该区域称为可变区。可变区中存在可以与抗原特结合的部位,即抗原结合位点。一个抗体有两个抗原结合位点,可以同时结合两个抗原分子。在可变区中有三个区域的序列高度变化,成为高变区(hypervariable region,HVR)又称为抗原互补决定区(complementarity determining region,CDR)。可变区主要通过其3个CHR区形成3个环状结构与抗原特异性结合。可变区中非CDR部分成为骨架区(framework region,FR),其氨基酸组成和排列变化相对CDR较少。可变区中CDR与FR的组成方式为“FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4”
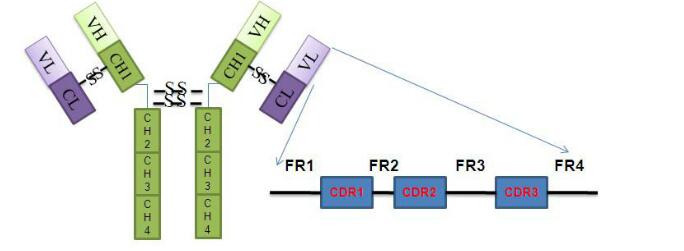
图2:IgG抗体结构示意图
抗体分子C端氨基酸序列相对稳定,该区域称为恒定区。同一种抗体的恒定区是相同的。抗体轻链的恒定区由一个Ig结构域构成;重链的恒定区由3-4个串联的Ig结构域及一个用于增加灵活性的铰链区构成。IgA、IgE、IgG有三个结构域(CH1、CH2、CH3),IgD、IgM有四个结构域(CH1、CH2、CH3、CH4)。不同种类抗体的铰链区存在一定的差异,IgA的铰链区较短,IgD 的铰链区较长,IgM 和IgE 无铰链区。
IgG分子在木瓜蛋白酶的作用下可以被降解为两个Fab段及一个Fc段。Fab段由抗体轻链的可变区、轻链的恒定区、重链的可变区及重链恒定区构成。可变区是与抗原结合的部位,因此Fab段又称为抗原结合段(详细Fab片段介绍)。
Fc段包含了所有抗体分子共有的蛋白质序列以及各个类别独有的决定簇。Fc段有多种生物学活性,具有结合补体、结合Fc受体、通过胎盘等作用。
| 抗体 | IgG | IgA | IgM | IgD | IgE | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 重链类型 | γ | α | µ | δ | ε | |||||||
| 重链亚型 | γ1 | γ2 | γ3 | γ4 | α1 | α2 | / | / | / | |||
| 重链MW(kDa) | 50 | 50 | 60 | 50 | 55 | 55 | 70 | 62 | 70 | |||
| 轻链MW(kDa) | 23 | 23 | 23 | 23 | 23 | 23 | 23 | 23 | ||||
| 总MW(kDa) | 150 | 150 | 170 | 150 | 160(血清) 600(分泌) |
160(血清) 600(分泌) |
970 | 180 | 190 | |||
| 补体结合 | 弱 | 弱 | 强 | 无 | 无 | 无 | 强 | 无 | 无 | |||
| Fc受体结合 | 强 | 弱 | 强 | 弱 | 有 | 有 | 有 | 有 | 有 | |||
| 胎盘转移 | 强 | 弱 | 强 | 强 | 无 | 无 | 无 | 无 | 无 | |||
| 抗体亚型 | IgG | IgA | IgM | IgD | IgE | ||||
|---|---|---|---|---|---|---|---|---|---|
| 重链类型 | γ | α | µ | δ | ε | ||||
| 重链亚型 | γ1 | γ2a | γ2b | γ3 | |||||
| 抗体MW(kDa) | 160 | 160(单体) 350-400 |
900 | 180 | 190 | ||||
| 血清半衰期(天) | 8-11 | 3-12 | 2.6-3.5 | 4-8 | 0.5-1 | 0.5-1 | <1 | <1 | |
| 碳水化合物比例(%) | 2-3 | 7-11 | 9-12 | 12-15 | 12 | ||||
| 补体结合 | 弱 | 强 | 强 | 中 | 弱 | 强 | / | / | |
| 沉降系数 | 6.6 | 6.7 | 19 | 6.8 | 8 | ||||
摘要:本文对全人源化单克隆抗体制备技术中的转基因小鼠技术进行概述和整理,主要内容包括转基因小鼠制备全人单抗原理简介,优缺点的对比以及四种常用的实验方法介绍。
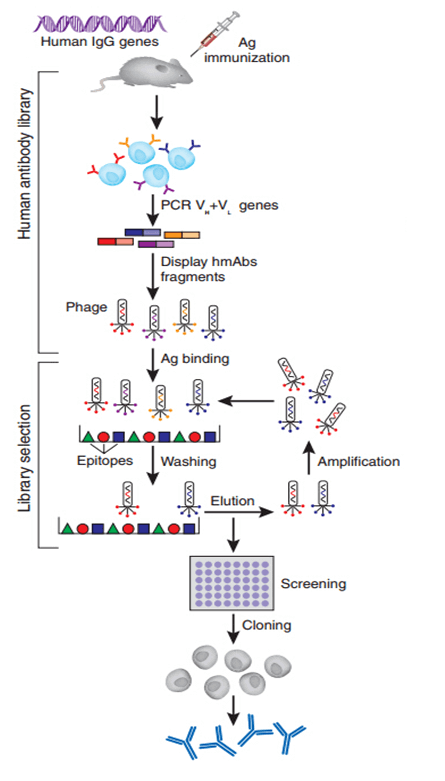
转基因小鼠制备全人源抗体的实验原理是:在抗体生成过程不是从普通小鼠开始,而是从鼠抗体生成基因被相应人基因所取代的小鼠开始。该方法要求人的抗体基因片段在小鼠体内必须进行较为有效的重排与表达,并且这些片段能与小鼠细胞的免疫系统信号机制相互作用,使得小鼠在受抗原刺激后,这些人抗基因片段能被选择,表达并活化B细胞分泌人抗体。其基本方法是采用在鼠胚胎干细胞(ES)中的同源重组来使得鼠原有基因缺失,再通过显微注射等技术将重建的人源抗体胚系基因微位点转入小鼠体内,最终由mAb的杂交瘤分泌出全人序列的抗体。
转基因小鼠制备全人源抗体的主要优点是,其功效要优于其他生产抗正常人体蛋白mAb技术。小鼠识别抗原和动员抗该抗原的抗体系统仍保持完整,容易把人体蛋白识别为异物。而且,由于抗体是在体内产生,经历正常装配和成熟过程,从而保证成品具有较高的靶结合亲和力。另一方面,用转基因小鼠生产候选mAb药物时间较短,费用较低。
转基因小鼠技术目前主要存在以下几个问题。一是免疫耐受的问题, 虽然可以通过免疫佐剂的使用和免疫方法的改进来提高免疫反应强度,但对于一些人类抗原仍然较难获得高亲和力抗体; 二是上述提到的存在鼠源抗体干扰的问题; 三是存在对毒性抗原较难进行免疫等问题。
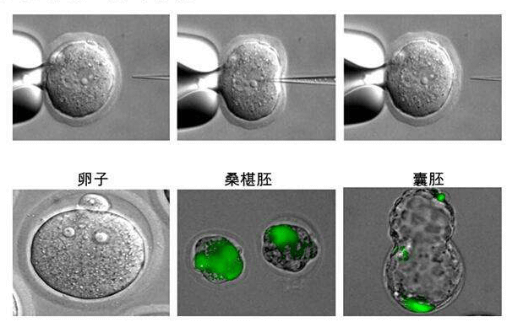
该法又称DNA显微注射法,即通过显微操作仪将外源基因直接用注射器注入受精卵,利用外源基因整合到DNA中,再通过胚胎移植技术将转基因胚胎移植到代孕受体动物子宫中,经过体内发育获得转基因动物。该方法的特点是外源基因的导入整合效率较高,不需要载体,直接转移目的基因,目的基因的长度可达200kb,较少产生嵌合体等。它可以直接获得纯系,所以实验周期短。
然而该方法有一些缺点使其很难在大动物中广泛应用:(1)显微操作仪器昂贵;(2)技术操作复杂,要求经过专门训练的技术人员操作仪器;(3)显微注射导入的外源基因在基因组中随机整合,可能导致内源性功能基因突变或者激活一些致癌基因,无法调控外源基因在基因组中的整合数目(拷贝数);(4)外源基因整合效率较低,构建转基因大动物成本较高;(5)只能实现目的基因的整合,不能进行基因敲除研究。尽管如此,在体细胞核移植技术出现前,显微注射法是被广泛使用和效果最好的转基因技术。
逆转录病毒感染法是最早被用于制备转基因动物的方法。常用的病毒载体包括逆转录病毒载体和慢病毒载体。
该方法首先将目的基因片段克隆至病毒载体的长末端重复序列(long terminal repeat,LTR)的下游,利用病毒系统将含有目的基因的载体包装成高滴度的病毒颗粒,以该病毒颗粒侵染动物受精卵或者胚胎, 也可以直接将胚胎与能释放逆转录病毒的单层培养细胞共孵育以达到感染的目的, 通过病毒将外源目的基因插入整合到宿主基因组DNA中去。这种逆转录病毒被用重组DNA技术修饰后作为基因载体在应用中优于微注射法之处为:无需重排, 可在整合点整合转移基因的单个拷贝;将胚胎置于高浓度病毒容器中, 或者与被感染的细胞体外共同培养, 或微注射鸡胚盘里,整合有逆转录病毒的DNA的胚胎率高。但是逆转录病毒载体具有感染宿主较窄,产生嵌合体动物的概率高等缺点,限制了其在转基因动物制备中的应用。随着病毒载体的发展,目前慢病毒载体逐渐成为病毒载体法的主导方法。
与一般的逆转录病毒载体法相比,慢病毒载体法具有感染宿主范围广,可感染几乎所有类型的细胞(分裂细胞和非分裂细胞),一般对细胞的感染力可达90%以上,具有较强的基因组整合能力。外源基因整合进入基因组织,可以稳定遗传。2010年,刘明军等利用慢病毒载体法制备转基因绵羊,对新生的162只羔羊进行检测,发现其中92只为转基因羔羊,平均转基因效率高达56.8%,显示出慢病毒法高效制备转基因动物的优势。但是慢病毒自身有潜在的致癌性,安全性有待提高,病毒载体容量不够大,目前只能插入小于10kb的外源基因。
近年来利用精子作为外源基因的载体来建立转基因动物极为令人注目。其方法就是将成熟的精子与外源DNA进行预培养之后, 使精子有能力携带外源DNA进入卵子中, 使之受精, 并使外源DNA整合于染色体中。精子携带DNA主要是通过三种途径来完成, 即将外源DNA与精子共孵育、电穿孔导入法和脂质体传染法。该方法简单、方便, 依靠生理受精过程, 免去了原核的损伤。1989年Lavitrano等首次利用小鼠附睾精子与DNA温育产生转基因小鼠。转基因效率高达30%, 外源基因稳定整合到生殖细胞中, 由此获得了转基因株系。所以这些引起了广大科研工作者的极大兴趣, 以精子作为载体、针对不同动物品种的研究工作相继展开。
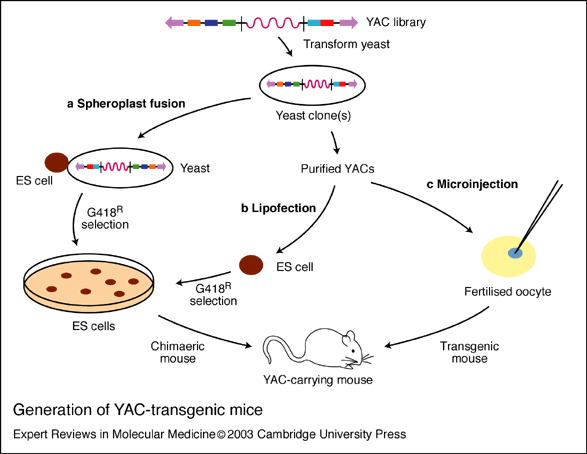
YAC系统是1987年发展起来的。该技术主要是将未重排的人类免疫蛋白胚系基因,首先构建成酵母人工染色体(yeast artificial chromosome,YAC),并把其转人小鼠即可获得分泌人抗体的转基因鼠。Mendez等采用改进的细胞融合法:去掉含有YAC的酵母细胞壁,使其球状原生质与鼠胚干细胞(ES融合)。然后把整合有目的基因的ES细胞导人小鼠囊胚,使之发育为嵌合体小鼠,再通过转基因鼠间反复交筛选,最终可获得分泌完全人抗体的小鼠。分别以人白细胞介素-8(IL-8)、表皮生长因子受体(EGFR)、肿瘤坏死因子-α(TNF-α)和淋巴细胞表面抗原(CD4)等抗原免疫该鼠,再取其脾细胞以杂交瘤技术与鼠骨髓瘤细胞融合。经筛选获得针对上述抗原的分泌高效价人抗体的杂交瘤细胞株。该技术明显优于微基因重组法,所获抗体的亲和力显著提高。但由于大量Ig相邻基因片段的同源重组过程复杂,以及包含所有Ig恒定区基因的YAC克隆困难,到目前还不可能把所有人Ig基因转入小鼠,故产生的抗体类型有限,仅能产生IgM和IgG2。
参考资料:
1.孙志伟, 王双, 陈惠鹏. 转基因小鼠在抗体药物研发中的应用. 军事医学科学院生物工程研究所, 2012
2.吴玉龙, 赵冬梅. 全人源抗体制备技术研究进展. 滨州医学院人体寄生虫学教研室, 2005
3.王锋, 倪培华, 宋巍, 周同. 利用转基因小鼠及转染色体小鼠产生人抗体的研究进展. 上海第二医科大学附属瑞金医院, 2001
免疫组化技术的全称为免疫组织化学技术(Immunohistochemistry,IHC)。
免疫组化于上世纪40年代出现,在60年代后发展迅速,经历了几十年的快速发展,该技术应用范围已覆盖到医学各个学科,已经成为当今生物医学形态、功能、代谢综合研究的一项有力工具。
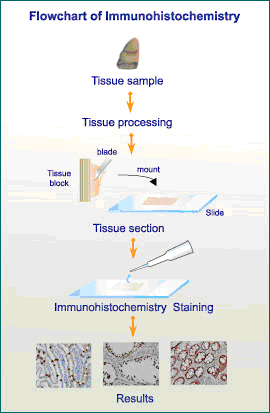
免疫组化,是用标记的特异性抗体对组织内抗原的分布进行定性,定位分析的检测技术。
免疫组化技术原理是:从待检测组织或细胞中提取蛋白作为抗原,通过免疫动物获得特异性抗体,利用抗体探测并结合组织(或细胞)中的抗原。再利用带显色剂标记的二抗检测,对细胞复染显示细胞轮廓,通过显微镜观察,可以实现对组织或细胞内蛋白的定性、定位研究。
免疫组化、Western
Blot、ELISA被称为免疫学三大工具,分别用于定位,定性和定量检测。
| 免疫组化 | Western Blot | ELISA | |
|---|---|---|---|
| 实验原理 | 免疫反应;化学显色反应 | 免疫反应;化学显色反应 | 免疫反应;化学显色反应 |
| 检测样品 | 组织石蜡切片或冰冻切片 | 蛋白 | 血清、细胞、组织培养上清等 |
| 定位检测 | 是 | 否 | 否 |
| 定位检测 | 是 | 是 | 是 |
| 定量检测 | 半定量[1] | 半定量 | 定量检测 |
定位和定性是免疫组化最大的优势。相比于其他蛋白检测方法,免疫组化具有定位较直接准确、定性灵敏度高,是定位检测分析首选方法,尤其对于有些因子的转位研究十分有用。免疫组织化学的临床应用主要包括以下几方面:
近年来,随着免疫组织化学技术的发展和各种特异性抗体的出现,使许多疑难肿瘤得到了明确诊断。免疫组化在肿瘤诊断和鉴别诊断中的实用价值受到了普遍的认可,其在低分化或未分化肿瘤的鉴别诊断时,准确率可达50%-75%。
根据标记物的不同(标记物有荧光染料、放射性同位素、酶、铁蛋白、胶体金等),免疫组化方法可以分为:免疫酶法、免疫荧光法、亲和组织化学法、免疫铁蛋白法、免疫金法及放射免疫自影法等。其中比较常用的是免疫酶法、免疫荧光法、亲和组织化学法,本文以免疫酶法为例,对免疫组化的操作流程做一介绍。
即用型Elivision快速酶免疫组化二步法的孵育及显色流程:一抗+酶标二抗+辣根酶底物显色。
SP法的孵育及显色流程:一抗+生物素二抗+滴加试剂SP(链霉菌抗生物素蛋白-过氧化物酶复合物)+辣根酶底物显色,SP是最常用的实验方法。
ABC法的孵育及显色流程:一抗+生物素二抗+滴加试剂ABC(卵白素-生物素-过氧化物酶复合物)+辣根酶底物显色。
SABC法的孵育及显色流程:一抗+生物素二抗+滴加试剂SABC(链霉卵白素-辣根酶标记生物素复合物)+辣根酶底物显色。
免疫组化实验通常需要设置阳性对照、阴性对照(或替代对照)(阳性对照是排除方法和实验系统有无问题;阴性对照与替代对照是排除有无非特异性染色)。
一般情况下,阳性对照颜色的特点为:Ag定位,包浆、胞核、胞膜、间质具有结构性。且染色的强度不同(颜色深浅不一);阴性对照的特点为:染色细胞与组织无区别,颜色具有弥散性,分布均匀。
| 阳性对照 | 阴性对照 (或替代对照) |
实验组 | 结论 |
|---|---|---|---|
| – | – | – | 操作错误 |
| + | + | + | 非特异性反应 |
| + | + | – | 阴性对照含定位Ag |
| – | – | + | 阳性对照不含定位Ag |
| – | – | + | 受检组织非特异性染色 |
| + | – | + | 受检组织不含定位Ag |
| + | – | + | 受检组织含定位Ag |
注:+表示实验有特异性染色;-表示实验无特异性染色
上表为免疫组化实验中可能出现的结果,由上表可以看出,只有6、7组的实验结果有意义。1~5的实验结果因IHC技术操作存在错误等原因使对照组的实验结果失去对照意义,必须重复实验或者换用Ab。
说明:免疫组化实验可以对结果进行定量分析,但要实验得到的必须是高质量的染色切片,要求背景染色浅且特异性染色较深,这样分析的结果才会比较准确。
 为什么在显微镜下观察发现所有的切片都成阴性?
为什么在显微镜下观察发现所有的切片都成阴性?注释:[1] 半定量是介于定性与定量之间的一种分析方法, 指虽然可以得到一个量值,但是这个量值只能从趋势上进行分析,例如大量、少量、微量、痕量等,而得不到一个具体的数值(例如浓度等)。
 第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于这两部分在空间结构上相对独立,其独特的抗原亲和力保持得很好,但因为有鼠McAb可变区的存在,应用时仍有强烈的HAMA反应。
第一代人源化抗体是将鼠McAb的可变区和人抗体的恒定区组成嵌合抗体。由于这两部分在空间结构上相对独立,其独特的抗原亲和力保持得很好,但因为有鼠McAb可变区的存在,应用时仍有强烈的HAMA反应。
在此基础上,进一步将鼠McAb可变区中相对保守的骨架区(Framework region, FR)换成人的FR,仅仅保留抗原结合部位的互补决定区(Complementarity-determining region, CDR),这才是真正意义上的抗体人源化。但起脚手架作用的FR不仅提供了CDR的空间构象环境,有时还参加抗体结合位点正确构象的形成,甚至参加与抗原的结合。因此,简单的CDR移植往往丧失或降低了原抗体的亲和力。如何在FR中、FR和CDR之间进行操作,目前有四种策略。
使用与鼠对应部分有较大同源性的人抗体FR替换鼠FR,在选择人FR时一般有两条途径。
第一种是对鼠McAb采用同一个(或少数几个)人源FR进行替换。已有晶体结构数据的人源抗体的可变区框架(VH如NEW,KOL,VL如REI等)用作替换的基本模板,借助序列比较与分子模建确定在人、鼠间有种源差异,尤其是鼠FR中与互补决定区CDR有密切作用的氨基酸残基,保留在替换的人源FR中。为了保持CDR的空间构象,要特别注意原来抗体的CDR下面的堆积残基,以及CDR周围的残基。
该途径的优点在于,确切的人源FR晶体结构为残基替换提供了较明确的信息;不足在于不易保持鼠CDR的天然构象,很可能降低或丧失抗体的亲和力。
第二条途径是,在已有的抗体序列库中搜寻与鼠McAb FR有最大同源性的人源FR用以替换。在选择同源的人FR时,先前的工作者倡导将VL和VH作为一个整体来考虑,寻找最高同源的人FR。其理由是同一个抗体的VL和VH在折叠上更能匹配。以后的工作者则认为,将VL和VH分开考虑,分别寻找最高同源的对应序列,更好地保持FR原来的框架,在整体上给鼠CDR提供最类似的环境。总之,同源替换主要考虑的是,鼠CDR在此背景下有类似的折叠环境,从而可保持原来的构象。同样需要分子模建来提供CDR移植后可能或缺的FR关键残基的信息。同源替换的优点是,能减少需要更改的氨基酸数目,更好地保持CDR需要的空间环境;不足的是选择的人源FR可能并无结构数据,不能提供有效的关键残基信息。
对鼠CDR及FR表面残基进行镶饰(veneering)或重塑(resurfacing),以使之类似于人抗体CDR的轮廓(profile)或人FR的型式(pattern)。
表面重塑途径的一个前提是,鼠McAb可变区的免疫原性起源于它的表面残基。因为残基的运动性和溶液可及性是其成为抗原决定簇的基本条件,因此表面残基理应携带全部或绝大部分的抗原表位。溶液可及性表面残基的划分标准是—构成该残基的全部原子的30%以上是溶剂可及的。尽管人、鼠间抗体可变区表面暴露残基的精确型式有差别,但大多数的表面位置的残基类别有强烈的倾向性,仅仅考虑这种表面型式就可分出抗体可变区的组别。这说明抗体可变区表面至少也和框架区核心一样保守,表面型式的差别是人鼠间抗体的主要差别。根据对现有的抗体晶体结构数据的分析结果统计,在序列配对位置上,人、鼠间抗体可变区残基的相对溶剂可及性分布的保真度达98%。这说明在异种间诱导免疫反应的残基是由其余的种特异性溶液可及表面残基引起的。将鼠特异性表面残基换成人源性的,就可模拟人源抗体的表面轮廓,逃避人体免疫系统的识别,达到人源化的目的。该策略可以不进行同源模建,在序列同源分析的基础上,选择与鼠表面残基暴露类型最相匹配的人源型式进行,但不够准确。另外,如果要改变的残基在侧链大小、电荷、疏水性,或有可能形成氢键从而影响到CDR的构象,则不予改变。因为要改变的残基较少,能减少CDR-FR之间的不相容性。
该策略作为较新的一种人源化途径,还在逐步成熟阶段。鼠源McAb在人体引起的HAMA反应,究竟是完全由其表面的暴露残基引起,还是由表面残基与内部残基的共同贡献,涉及到抗体产生最基本的免疫学机制,而这种机制仍是目前探讨的热点。
在人FR选择与CDR有相互作用、与抗体的亲和力有密切关系或对FR空间结构折叠起关键作用的残基进行改变,以补偿完全的CDR移植。
立体结构数据和同源性分析表明:在抗原结合、稳定CDR构象、FR折叠(内部堆积)这几个方面而言,构成抗体FR的残基并不具有相同的重要性。以此为依据将这些残基分成3类:低风险性(low-risk)残基,即暴露于溶剂而对抗原结合和抗体结构贡献甚少的残基。替代这些位置的残基能降低免疫原性而几乎不影响抗体的亲和力;高风险性(high-risk)残基,即直接参与抗原结合、稳定CDR构象或FR折叠的残基。为了保持人源化抗体的活性,应尽量避免在这些位置进行替换。对中度风险性(moderate-risk)残基应谨慎从事。FR中的高风险性残基和某些中度风险性残基,通称为非CDR区补充调控残基(non-CDR complementarity modulating residues)。它们散布于线性序列的不同位置,为每个CDR回折(loop)提供了合适的”平台”。其形状和侧链大小协同决定CDR的基本构象,并影响其抗原结合的特异性。因而将CDR搬到人源FR后,必须将人FR中的这些位置替换成鼠源非CDR区补充调控残基以补偿完全的CDR移植。
这种分析方法使人源化突变方案具有选择性和针对性,避免了盲目的可能导致失败的探索。通过在中度风险性残基中进行变化,还有可能提高人源化抗体的亲和力。不足的是对残基的分类要以晶体数据和三维结构为基础,才能提供准确的标准。
人源化McAb保留了鼠源McAb可变区中参与抗原结合的氨基酸残基,包括CDR和FR中的一些关键残基。尽管鼠框架区的其余部分可以从某个人FR中搬移过来,毫无疑问,这样得到的人源化抗体序列和人抗体的保守序列(consensus sequences)在一些位置上有差别。这些来源于个体型抗体亲和力成熟过程中体细胞突变的非典型残基,应用于病人后会诱导免疫反应。因此,理想的途径是,以人FR保守序列为模板进行人源化。由于人抗体轻、重链可变区不同亚类的保守序列并不相同,需要一种合适的方法来寻找最适保守序列。最简位置模板(minimal positional template)表明,抗体可变区中哪些位置绝对需要保持抗体的抗原结合结构域的完整性,提供了确定关键位置的方法。
在选择人框架区时,首先从现有的人源抗体保守序列中搜寻与鼠框架区最类似的序列;其次根据最简位置模板确定鼠可变区的关键位置残基;最后保留所有这些位置而将其余部分进行人源化。
以上所述人源化的四种策略均以保持抗体的亲和力为核心,以降低免疫原性为目标,各有特点。总之,抗体人源化设计的关键步骤是:
在设计过程中,同源分析和分子模建提供了必需的辅助手段。虽有一些一般性原则,但对某一具体的鼠McAb进行人源化时则必须具体分析。
本文介绍了通过人鼠嵌合抗体重链基因转染小鼠骨髓瘤J558L的研究,较详尽地阐述了用原生质体融合法将重组的人鼠嵌合抗体重链基因转染到J558L骨髓瘤细胞中,并用ELISA法检测转染子的过程和方法。
细胞株:骨髓瘤细胞株J558L,本身能合成免疫球蛋白λ轻链多肽, 但不分泌到细胞外。
供体菌株:E.coli HB101,带有含人鼠嵌合抗体重链基因的pSV2ΔHgptS107VHHuG4质粒。
细胞长生培养基:IMDM + 1%庆大霉素 + 1%制霉菌素 + 10%小牛血清。
H×M:选择培养基 + 次黄嘌呤(0.45ug/ml) + 黄嘌呤0.03mg/ml + 霉酚酸(0.6mg/ml)。
羊抗人IgG:辣根过氧化物酶标的绵羊抗人IgG。
溶菌酶溶液:5mg/ml溶在250mmol/L Tris溶液(PH 8.0)。
PEG-DMSO:47.1% PEG1500-12.5% DMSO-100mmol/L Tris,用DME配制。
导读:单克隆抗体技术是现代生命科学研究的重要工具,其在基因和蛋白质的结构与功能研究方面有着不可或缺的作用。本专题提供了专业的单克隆抗体相关技术文章,主要包括:单克隆抗体的结构与作用机制,单抗的分类,常用的单抗制备方法:杂交瘤单抗技术、噬菌体展示技术、单B细胞抗体发现技术与重组单克隆抗体技术,抗体配对与标记,抗体亚型鉴定和多种亲和力测定方法等。
单克隆抗体(monoclonal antibody,McAb)是由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤(hybridoma)技术来制备——杂交瘤抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的B细胞和具有无限生长能力的骨髓瘤细胞融合为B细胞杂交瘤…Read More>>
主要介绍了单克隆抗体与多克隆抗体区别以及在不同方面的对比,主要包括单抗与多抗定义的介绍,单抗与多抗制备技术流程的区别与对比、以及单抗多抗的在研究中的优缺点和实际应用中的区别。并附有详细的对比表格…Read More>>
德泰生物提供的单克隆抗体制备技术服务包括: SingleB®鼠单抗制备、SingleB®兔单抗制备、磷酸化抗体制备、小分子抗体制备、快速杂交瘤单抗制备等。德泰生物可以提供完善的单克隆抗体生产设施和全面的技术服务…Read More>>

杂交瘤技术的原理、杂交瘤细胞特点及杂交瘤技术的优缺点做一简述。杂交瘤技术又称为单克隆抗体制备技术,将免疫动物的脾细胞与骨髓瘤细胞融合,可以得到既能产生抗体又能无限增殖的杂交瘤细胞,对杂交瘤细胞进行培养,可得到单克隆抗体。
噬菌体展示技术是将不同的外源基因分别插入噬菌体载体中,随着噬菌体的传代,外源蛋白会展现在噬菌体表面,形成噬菌体文库。随后用特定蛋白对噬菌体文库进行筛选,便可快速的得到与该蛋白具有高度亲和力的抗体。

主要介绍了抗体片段scFv,Fab,双特异性抗体,Fc 融合蛋白,抗体人源化,亲和力成熟等技术及原理。重组抗体的生产,不需要使用动物,已知抗体序列,直接克隆到质粒上进行抗体表达,可以快速实现单克隆抗体的大量重复制备。
表面等离子共振技术(surface plasmon resonance technology,SPR)是上个世纪80年代发展起来的以生物传感芯片(biosensor chip)为中心的一种新技术。此后人们开始研究用各种方法改进SPR的性能、简化仪器系统,并试图用SPR技术测量不同的生化物质,测试范围包括:
本文对于表面等离子共振技术的原理和其在测定抗体亲和力作了简要的概述。
全内反射是一种普遍存在的光学现象。考虑一束平面光波从介质1表面进入到介质2中。入射光在介质1表面上一部分发生反射,另一部分则透射进介质2。入射角和透射角之间满足关系式:
这里n1是介质1的折射率,n2是介质2的折射率。当入射角增大,增大到临界角θc 时,这时的透射角为90°;当入射角继续增大到大于临界角时,光不再透射进介质2,也就是发生了全反射。由snell定律可知:
由上式可知,当n2<n1时,全反射就可能发生。从几何光学的角度来看,当光发生全反射时,光会在介质1界面上完全反射而不进入介质2中。实际上,由于波动效应,有一部分光的能量会穿过界面渗透到介质2中,平行于界面传播。这部分光场就是所谓的消失波。一般情况下隐失波在折射率小的介质中传播一段距离,再回到折射率大的介质,使光的全部能量都回到第一介质中。如果隐失波的频率与金属表面振荡的自由电子(即等离子)频率一致,则金属表面的等离子就吸收光能发生共振(surface plasmon resonance,SPR),使反射光强度减弱,这时的入射角为共振角(SPR角)。SPR随金属表面的折射率变化而变化,而折射率的变化又和结合在金属表面的生物分子质量成正比,因而可通过对生物反应过程中SPR角的动态变化获取生物分子相互作用的特异信号。

表面等离子共振仪芯片结构
在表面等离子共振仪中,最核心的结构是芯片。芯片的玻璃表面附有一层金膜,一种待检分子(ligand)连在金膜上,入射光在金和玻璃表面发生全反射,并产生SPR,这时的入射角为I。当有一种分子analyte与ligand相互作用时,使金箔的折射率发生变化,这时以原来的入射角(I)入射就不能发生SPR,而以入射角(II)入射才能发生SPR。用楔形的入射光入射保证了入射角在一定范围内,并能实时检测。在analyte与ligand相互作用后,以缓冲液流过芯片表面,使analyte和ligand相分离,从而芯片得到再生,可以重复使用。

表面等离子共振仪工作原理

传感图曲线
与常规的亲和力检测方法(竞争ELISA,电泳条迁移等)相比,SPR具有以下优势:
抗体亲和力测定的方法很多,竞争ELISA法是一种简便易行的亲和力测定方法,本文主要介绍竞争ELISA法测定抗体亲和力的原理、操作步骤以及注意事项。如果想了解更多抗体亲和力的测定方法,查看抗体亲和力测定方法介绍。
在半饱和状态下,如果抗体的浓度很低,反应消耗的抗原很少,则反应后游离的抗原浓度[B]约等于总的抗原浓度[B]总,此时Kd=[B]≈[B]总。因此,只要在抗体浓度较低的情况下,找到可以在反应平衡后达到半饱和状态的抗原浓度[B]总,便可以得到解离常数。
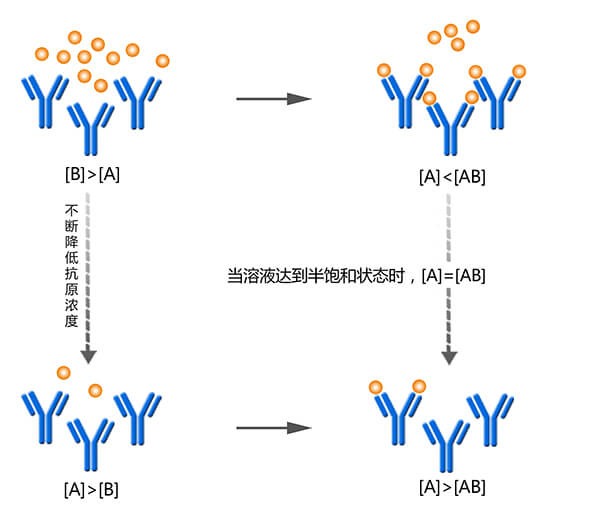
竞争ELISA法测出的Kd值的准确性,依赖于一个大前提:将反应混合物加入包被抗原板后,包被抗原与游离抗体的结合不会破坏抗原抗体反应体系的平衡状态(如果抗原板中抗原浓度过高,结合的游离抗体超过了一定的量,抗原抗体反应体系的平衡会被破坏,此时测得的OD值偏大,最终导致结果偏大)。通常允许抗原板结合的最大游离的抗体量为10%。在进行ELISA法检测抗体亲和力实验时,需要确保抗原不会破坏反应体系的平衡。通常可以用以下操作步骤来确定该包被抗原的浓度是否过高:
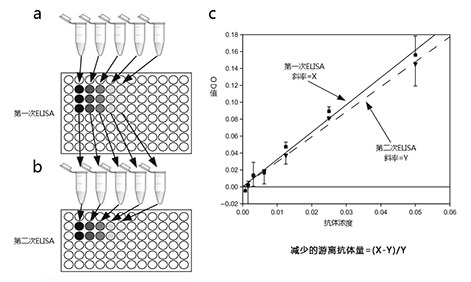
抗原浓度较低时,反应平衡后[A]较大,被抗原板捕获的游离抗体多,信号强;当抗原浓度高时,反应平衡后[A]较小,被抗原板捕获的游离抗体少,信号弱;当抗原浓度髙到一定程度时,将没有信号。在最强信号一半时的状态为半饱和状态,此时[A]=[AB],Kd=[B]≈[B]总。将测得的OD值记录,结合梯度稀释的抗原浓度绘制拟合曲线,最终找到最强信号一半的点,对应的抗原浓度即解离常数Kd。
酶标抗体建议不要使用HRP偶联抗体,竞争ELISA法测抗体亲和力实验是在抗体浓度很低的条件下进行,利用HRP偶联抗体并不能很好的获得信号。为了获得更好的信号,建议使用AP偶联的鼠单克隆抗体。
德泰提供抗体亲和力检测服务,可以准确的测定抗体的亲和力。
亚型指的是相同的构成方式,但是空间结构不同的蛋白质结构。抗体亚型,指的是在机体内产生的“Y”构型的免疫球蛋白(Ig),基于小分子多肽结构上的差异,可以进一步的进行细分。
抗体以一个或者多个“Y”字形单体存在,每个“Y”字形单体由 4 条多肽链组成,包含两条相同的重链和两条相同的轻链。 通常,抗体的种类由重链决定。例如哺乳动物Ig的重链一共有五种,分别用希腊字母α、δ、ε、γ和 μ 来命名,相对应组成的抗体就称为 IgA、IgD、IgE、IgG 和 IgM。其中,人的γ可以进一步细分为γ1、γ2、γ3、γ4等亚类,分别对应IgG1, IgG2, IgG3和IgG4四个亚型,小鼠γ可以进一步细分为γ1、γ2a、γ2b、γ3等亚类,分别对应IgG1, IgG2a, IgG2b和 IgG3四个亚型。
哺乳动物有两种轻链:λ型和κ型。出于科研的需要,人们也会对轻链的亚型进行鉴定。
| 类/亚类 | 重链 | 轻链 | 分子量(kDa) | 结构 | 功能 |
| IgA1 IgA2 |
α1 α2 |
λ或κ | 150-600 | 单体-四聚体 | IgA有血清型和分泌型,血清型IgA不显示重要的免疫功能,分泌型IgA存在于分泌液中,如唾液、泪液、初乳、鼻和支气管分泌液等,是机体粘膜局部抗感染免疫的主要抗体。 |
| IgD | δ | λ或κ | 150 | 单体 | 功能不详; 与IgM共同存在于B细胞发育的各个阶段;大部分与B细胞结合。 |
| IgE | ε | λ或κ | 190 | 单体 | 结合变应原引发巨细胞释放组胺,可以对抗寄生虫感染。 |
| IgG1 IgG2 IgG3 IgG4 |
γ1 γ2 γ3 γ4 |
λ或κ | 150 | 单体 | 血清中最主要的免疫球蛋白。在免疫反应中最主要的抵御病原的侵袭的抗体为IgG; 可通过胎盘。 |
| IgM | μ | λ或κ | 900 | 五聚体 | 最早产生的反应性抗体,在B细胞表面表达,分泌型有很高的亲和力。在B细胞介导的免疫反应早期,产生足够的IgG之前发挥消除病原菌的作用。 |
表1:不同亚型抗体的结构与功能
 抗体亚型鉴定的原理是利用酶联免疫吸附实验(ELISA),测定待测抗体与不同亚型特异性的抗体的结合情况,找出可以与待测抗体特异性结合的抗体,由于与待测抗体结合的抗体的特异性都是已知的,依据结合抗体的特异性可以得出待测抗体的亚型。以小鼠抗体亚型的测定为例,利用ELISA测定待测抗体与针对小鼠IgG1、IgG2A、 IgG2B、 IgG3、IgM、λ、κ有特异性的抗体的结合情况。如果待测抗体抗体可以与针对小鼠IgG1的特异性抗体结合(通过肉眼观察颜色深浅或通过测OD值判断),则该抗体的亚型为IgG1。以此类推,也可以测出轻链的亚型。
抗体亚型鉴定的原理是利用酶联免疫吸附实验(ELISA),测定待测抗体与不同亚型特异性的抗体的结合情况,找出可以与待测抗体特异性结合的抗体,由于与待测抗体结合的抗体的特异性都是已知的,依据结合抗体的特异性可以得出待测抗体的亚型。以小鼠抗体亚型的测定为例,利用ELISA测定待测抗体与针对小鼠IgG1、IgG2A、 IgG2B、 IgG3、IgM、λ、κ有特异性的抗体的结合情况。如果待测抗体抗体可以与针对小鼠IgG1的特异性抗体结合(通过肉眼观察颜色深浅或通过测OD值判断),则该抗体的亚型为IgG1。以此类推,也可以测出轻链的亚型。目前比较常用的方法是利用试剂盒进行抗体亚型的鉴定,按照试剂盒说明书进行操作,便可以直观的读出抗体的亚型。
| 常见问题 | 可能原因 | 解决方案 |
| 多种重链结果 | 腹水中有杂抗体 | 将腹水样本至少 1:100000稀释 |
| 样本中抗体浓度过高 | 再将样本 1:2-1:10 稀释 | |
| 杂交瘤细胞中含有多种细胞系 | 亚克隆杂交瘤细胞 | |
| 显色较慢或颜色较弱 | 样本中抗体浓度低 | 减少稀释倍数;延长显色时间 |
| 结果难以判定 | 多种重链或轻链结果 | 再将样本 1:4 或 1:8 稀释后重新检测 |
表2:常见问题与解决方案
不同亚型的抗体在结构上有所区别,其免疫源性与在体内发挥的作用存在差异,对抗体进行进一步的细分,并进行抗体亚型鉴定,对于疾病作用机理的研究、抗体药物的开发有重要意义。
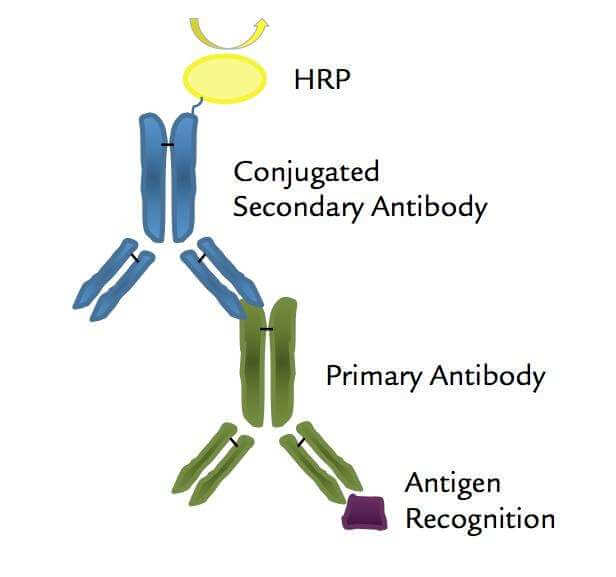 抗体标记是指将标记物(酶,荧光素,生物素等)共价连接到抗体上,与待检测物(如某些特定抗原)特异性反应形成多元复合物,并借助于荧光显微镜、射线测量仪、酶标检测仪、电子显微镜和发光免疫测定仪等精密仪器对试验结果直接镜检观察或进行自动化测定,可以在细胞、亚细胞、超微结构及分子水平上对抗原、抗体反应进行定性和定位研究或应用各种液相和固相免疫分析方法对体液中的半抗原、抗原进行定性和定量测定。目前抗体标记技术己被广泛用于医学病理学、免疫组织化学、分子生物学、生物制药等领域的分析研究与技术测定,常见的抗体标记技术包括酶标记法,生物素化标记法,荧光素标记法和胶体金标记法等。
抗体标记是指将标记物(酶,荧光素,生物素等)共价连接到抗体上,与待检测物(如某些特定抗原)特异性反应形成多元复合物,并借助于荧光显微镜、射线测量仪、酶标检测仪、电子显微镜和发光免疫测定仪等精密仪器对试验结果直接镜检观察或进行自动化测定,可以在细胞、亚细胞、超微结构及分子水平上对抗原、抗体反应进行定性和定位研究或应用各种液相和固相免疫分析方法对体液中的半抗原、抗原进行定性和定量测定。目前抗体标记技术己被广泛用于医学病理学、免疫组织化学、分子生物学、生物制药等领域的分析研究与技术测定,常见的抗体标记技术包括酶标记法,生物素化标记法,荧光素标记法和胶体金标记法等。
通过共价键经适当方法将酶联结在抗体上,制成酶标抗体,再借酶对底物的特异催化作用,生成有色的不溶性产物或具有一定电子密度的颗粒,这些有色产物可用肉眼、光学显微镜和电子显微镜观查,也可以用分光光度计测定,呈色反应显示了酶的存在,从而证明发生了相应的免疫反应。
实验中使用偶联剂使酶与抗体结合,即通过应用单、双或多功能试剂,分别与大分子的抗体所存在的功能性基团发生反应,生成酶—抗体偶联复合物。不同的酶—抗体复合物制备方法中,最广泛应用的戊二醛法,本法与其它偶联方法相比,具有操作简单、反应条件温和,及实用面广等长处。
酶标记抗体的质量主要取决于纯度好、活性强及亲和力高的酶和抗体,其次要有良好的制备方法。高质量的抗体则可通过提取纯化而获得。在制备方法上,宜选用产率高、不影响结合物的活性和不混杂干扰性物质且操作简便易行的方法。
辣根过氧化物酶(HRP)标记单抗和多克隆抗体的常用方法是过碘酸钠法。其原理是HRP的糖基用过碘酸钠氧化成醛基,加入抗体IgG后该醛基与 IgG氨基结合,形成Schiff氏碱。为了防止HRP中糖的醛基与其自身蛋白氨基发生偶合,在用过碘酸钠氧化前先用二硝基氟苯阻断氨基。氧化反应末了,用硼氢化钠稳定Schiff氏碱。
碱性磷酸酶(AKP)用于标记抗体,常用戊二醛一步法,将酶和单抗混合,再加入适量戊二醛,使酶和抗体蛋白的NH2分别与两个醛基结合,制备成结合物。该法简便,但所得产物不均一,抗体活性损失大,酶标记率低。
亲和素与生物素都可与蛋白质(包括抗原、抗体、酶等)、荧光素等分子结合而不影响后者的生物活性,是理想的标记剂。一个抗体分子可偶联数十个生物素或亲和素分子,而亲和素或生物素分子又可与酶或荧光素结合,从而组成一个生物放大系统,显著提高检测的灵敏度。常用的有亲和素–生物素标记法(Labeled avidin biotin,LAB)、亲和素-生物素桥法(bridged avidin biotin, BAB)和亲和素-生物素-过氧化物酶复合物法(avidin biotin peroxid ase complex,ABC)。本实验可使抗体或其它蛋白质的ε-氨基通过手臂与酰化的生物素共价结合。其后,生物素化的分子可应用酶标-亲和素或荧光染料-链霉亲和素复合物来检测。
BSA。将结合产物置4℃,避光保存,亦可加入50%重蒸甘油,置―20℃保存。
荧光抗体标记技术是将荧光素以化学方法与特异性抗体共价结合,形成荧光素-蛋白质结合物(即荧光标记抗体),此结合物仍保留着抗体活性,同时具有荧光素的示踪作用。当它与相应的抗原特异结合后,借助于荧光显微镜观察呈现明亮的特异荧光。实验中常用异硫氰基荧光黄(fluorescein isothiocyanate, FITC)作为标记物,在碱性溶液中,FITC上的化学基团异硫氰基(-N=C=S)与抗体蛋白自由氨基(主要是赖氨酸的ε-氨基)结合,形成荧光抗体,以测定细胞相应抗原的存在。FITC具有很高的量子产量(发射光与吸收光的比值,0 .85),而且形成的偶联物的稳定性很好。FITC是应用最广的荧光染料,流式细胞仪就按FITC的特性,设计了激光波长为488 nm,很接近于FITC的最大激发波长492nm)。
胶体金是一种常用的标记技术,是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术,有其独特的优点。近年已在各种生物学研究中广泛使用。在临床使用的免疫印迹技术几乎都使用其标记。同时在流式、电镜、免疫、分子生物学以至生物芯片中都可能利用到。
胶体金在光镜和电镜中均为有效的标记物,可以检测单一和多重抗原。胶体金在电解质中不稳定,但被蛋白质包被的胶体金是稳定的。一般常用免疫球蛋白或蛋白A包被胶体金,可作标记二抗进行免疫检测,本方法应用范围广,染色后的样品可以长期保存。
10%氯化钠溶液,静止5分钟;以胶体金溶液为空白对照测定光吸收度,选择最低吸收值的蛋白质浓度用于正式包被。
抗体标记服务:提供生物素标记,FITC荧光标记,HRP标记等。

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved