
抗体融合蛋白(Ig融合蛋白)是指在基因水平上将目的基因同免疫球蛋白部分片段基因相连,并在真核或原核表达系统中表达的重组蛋白。抗体融合蛋白具有抗体的特性及融合功能蛋白的活性,可广泛应用于免疫诊断、免疫治疗、抗体纯化及抗体和抗原的定量分析等,特别可用于免疫导向药物的制备。根据结合的Ig片段的不同,可以将抗体融合蛋白分为Fab融合蛋白、Fc融合蛋白与单链抗体(scFv)融合蛋白。
Fab融合蛋白、单链抗体融合蛋白
研究表明,抗体可变区的N端空间结构上与互补决定区(CDR)形成的抗原结合部位十分接近,有的抗体可变区N端残基甚至直接参与抗原结合部位的形成,如果将效应蛋白与抗体片段的N端结合,可能对抗体可变区的空间构型造成较大影响,从而降低抗体与抗原的结合能力。因此,通常将蛋白与抗体片段的C端进行结合,形成抗体融合蛋白。
Fc融合蛋白
Fc融合蛋白在结构上是将抗体的Fc区与功能蛋白进行融合,可将Fc的N端或C端与目的基因进行融合。根据结合蛋白的不同,可以有多种构型(如下图)。
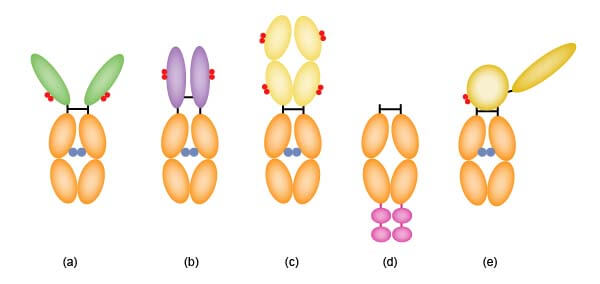
图1:Fc融合蛋白的构型
含有抗体可变区的抗体融合蛋白
Fab融合蛋白与scFv融合蛋白含有抗体的可变区,可以进行抗原-抗体反应,其作用原理为利用抗体-抗原特异性结合的特性,通过这种特性的引导,将具有生物活性的蛋白靶向引导至细胞的特定部位,进而发挥一定的生物效应,也就是所谓的“生物导弹”。
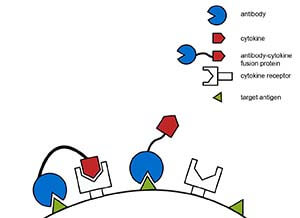
图2:Fab/scFv合蛋白作用原理

图3:Fc融合蛋白作用原理
不含抗体可变区的抗体融合蛋白
该类融合蛋白含有的抗体功能区为Fc区,不能进行抗原-抗体反应,Fc段的作用为延长药物在血浆内的半衰期、增加融合蛋白的稳定性等。Fc融合蛋白药理作用的发挥依赖于功能蛋白部分,利用受体-配体之间的相互作用产生一系列的生物学效应。
最初抗体融合蛋白制备的方法为化学交联法,但这种方法制备的抗体融合蛋白组成不均一、性能不稳定、免疫源性大,随着基因工程技术的发展,该技术已被淘汰。目前主要利用基因工程技术来进行抗体融合蛋白的制备。其制备原理为:将抗体基因与目的蛋白基因通过一段接头序列(linker)进行链接,然后将链接产物亚克隆至载体中,并用原核或者真核表达系统进行表达。
制备抗体融合蛋白过程中,一个关键的问题是两蛋白间的接头序列( Linker )的长度,linker的长短对蛋白质的折叠和稳定性非常重要。如果接头序列太短,可能影响两蛋白高级-结构的折叠,从而相互干扰;如果接头序列太长,又涉及免疫原性的问题。
抗体融合蛋白是将抗体的部分片段与目的蛋白进行融合表达得到的重组蛋白,若将两个具有不同抗原特异性的抗体片段连接至同一蛋白,即可得到双特异性抗体。
| 单克隆抗体 | 抗体融合蛋白 | |
| 结构 | Y型 | 具有多种结构 |
| 制备方法 | 杂交瘤技术/基因重组 | 基因重组 |
| 表达系统 | 真核系统/原核系统 | 真核系统/原核系统 |
| 作用原理 | 特异性识别抗原,Fc段引起ADCC、ADCP、CDC等作用。 | 功能蛋白与靶分子间的受体-配体的相互作用。 |
表1:单克隆抗体与抗体融合蛋白比较

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved