
原核表达(这里是指大肠杆菌表达系统)是目前常用的重组蛋白表达方式之一,操作相对简便,要求较低。相对哺乳动物表达系统更加经济节约。但是也常常遇到一些问题,比如原核表达蛋白表达量低?蛋白不表达?蛋白表达不在上清易形成包涵体等情况。本文主要根据实验经验总结原核蛋白表达的两个问题蛋白为什么不表达和蛋白表达为什么不在上清,并提出针对性的解决方案,帮助我们提高实验的成功率。原核表达FAQ主要内容如下;
细胞质中、细胞周质中、细胞外。
蛋白在细胞周质中表达:
细胞周质是指革兰氏阴性菌中、位于内膜和外膜之间的结构部分。周质中表达的蛋白质,分离纯化简单,而且周质中的氧化环境有利于蛋白质的正确折叠,但是蛋白产量很低。
蛋白在胞外表达:
胞外分泌是使大肠杆菌中的外源蛋白分泌到培养基中。
途径:
1、一些可被细胞内蛋白酶所降解的蛋白质分泌到周质或培养基中可增加其稳定性;
2、有些在细胞内表达时无活性的蛋白分泌表达时能够按适当的方式进行准确折叠,增加到蛋白的活性;
3、 由于蛋白质信号肽和编码序列间被切割,所以分泌蛋白产物不含氨基酸起始密码子ATG所编码的甲硫氨酸,而甲硫氨酸会影响许多蛋白的活性。
胞内表达是外源蛋白在大肠杆菌中主要的表达形式。但是由于大肠杆菌的细胞质环境呈现还原性,不利于蛋白二硫键的形成和稳定,从而导致蛋白的不准确折叠,形成不溶性的包涵体。
蛋白质动力学模型研究表达:活性蛋白的产率还取决于蛋白的合成速率,折叠速率和聚集速率,当外援蛋白的大肠杆菌中高效表达时,一旦形成新生肽链的聚集速度超过他的折叠速率就会导致包涵体的形成。
重组蛋白在大肠杆菌中大量表达时,很容易在胞内形成不可溶的包涵体,为后期的纯化、复性带来麻烦,而且复性所得到的蛋白活性很低甚至没有活性。因此,提高重组蛋白在大肠杆菌中的可溶性表达是十分必要的。
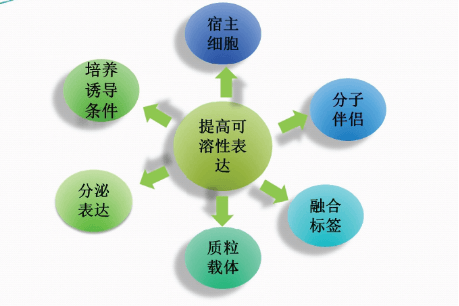
重组蛋白在大肠杆菌中表达很难准确折叠的主要原因是大肠杆菌的细胞质环境呈现还原性,不利于二硫键的形成。针对这一原因,研究人员对细胞内表达主要还原途径的两个关键酶的基因进行突变,构建了有利于二硫键形成,蛋白准确折叠的感受态细胞,如BL21(DE3)、Rosetta(DE3)等。
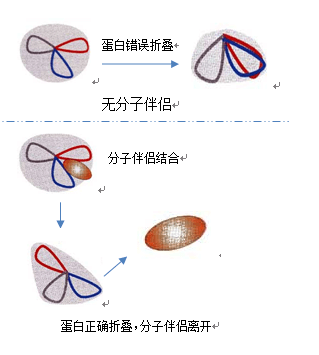
分子伴侣是一种帮助多肽链形成正确三维结构的蛋白质,它主要组织或校正出现不合理的疏水结构来帮助肽链的折叠。大肠杆菌内蛋白的折叠主要由两个分子伴侣系统负责。一个系统主要含有3个分子伴侣蛋白Dnak、Dnaj和GrpE,Dnak与新合成的蛋白质结合:Dnaj和GrpE是辅助分子伴侣,Dnaj通过水解与Dnak结合的ATO促进Dnak与底物结合,GrpE催化ADP和ATP转换释放出底物。
另一个系统包括GroEL和GroES,GroEL是分子伴侣,而GroES是辅助分子伴侣。根据蛋白表达特点选择合适的分子伴侣和重组蛋白共表达,可有效的提高蛋白的可溶性,但对于一些比较难折叠的蛋白,有时在分子伴侣的帮助下其可溶性也得不到改善。
融合标签用于检测和纯化目的蛋白,有时也通过增加目的蛋白在细胞质中的可溶性或帮助将目的蛋白转运到细胞周质中以提高目的蛋白的生物活性。在原核表达载体或蛋白序列中常添加一些可溶性标签,如GST,NusA,MBP,Sumo等,这些标签在宿主中表达的蛋白质会有高度的可溶性,在与外源蛋白质融合后,从而促进外源蛋白的可溶性表达。
降低蛋白的合成速率除了改变诱导条件,还可以通过更换弱启动子来调节。pET系列载体有T7/T7lac强启动子,提高了重组蛋白的表达量,但是也增加了形成包涵体的概率。为了提高蛋白的可溶性表达,我们可以选择让弱启动子或带有融合标签的载体,如pCold、pBAD、pGEX等,这些载体在重组蛋白表达上可一定比例的提高蛋白的可溶性。
分泌型表达通过将外源基因融合到编码原核蛋白信号肽序列下游就能实现。选用分泌型表达载体,将蛋白输出到细胞周质中,如pET20/22等。
当重组蛋白高效表达时,新生肽链的聚集速率一旦超过蛋白的折叠速率,此时,蛋白就会以包涵体的形式在细胞内形成。所以,降低蛋白的合成速率可一定程度上的改善重组蛋白的可溶性;
降低蛋白的合成速率有很多途径,对于固有的质粒载体来说,通常采用降低诱导温度和诱导剂浓度的方法。为了提高蛋白可溶性的同时保证蛋白的表达量,我们可以对不同温度梯度和诱导剂不同浓度梯度进行实验设计,从而得到最佳诱导表达条件。
培养基的组成对提高蛋白的可溶性也有一定的影响,减少培养基中的营养成分(如,将TB换成LB),或向培养基中 添加一些物质(如葡萄糖,镁离子,氯化钠,硫酸铵等)。
原核细胞RNA聚合酶能识别真核基因启动子。
从真核DNA转录的mRNA缺乏结合原核核糖体的SD序列,不能启动翻译过程。
真核基因中含有内含子,而原核细胞缺乏转录后加工体系,mRNA中内含子不能切除,不能形成成熟的mRNA,也就不能表达真核蛋白。
原核细胞缺乏真核细胞所特有的蛋白翻译后的修饰系统,不利于表达需要糖基化、磷酸化修饰才有活性的真核蛋白。
蛋白具有信号肽序列的真核基因在真核细胞内先表达成蛋白前体,在其穿越细胞膜向外分泌时,会被细胞膜上信号肽识别序列切除而分泌到细胞外。但是在原核细胞内表达时,不但影响蛋白的表达,同时由于大肠杆菌缺乏加工处理体系,不能正确切除信号肽,而表达的分泌蛋白的前体没有实物活性,常聚集在胞内。
1、翻译起始位点
现在大部分的表达载体都提供起始位点,所以它已经把起始密码子与核糖体结合位点的距离进行了优化,一般情况下不需要自己再添加,不过还是要留意载体图谱上是否注明有起始密码子和终止密码子。
2、GC含量
表达序列中的GC含量超过70%的时候可能会降低蛋白在大肠杆菌中的表达水平。
3、mRNA二级结构
在起始密码子附近的mRNA二级结构可能会抑制翻译的起始或者造成翻译暂停从而产生不完全的蛋白。
4、密码子的偏爱性
如果外源基因密码子的使用频率和宿主菌高效表达的基因密码子的使用频率差异较大,翻译时核糖体在稀有密码子处就会产生停顿,这不仅降低蛋白质的合成效率,导致新生肽链的错误折叠而影响延伸,甚至会停止翻译。
5、质粒载体的选择
构建质粒载体时,要考虑质粒上的元件包括启动子,多克隆位点,终止密码子,融合标签,复制子,筛选标记基因等因素。
6、基因或者蛋白的大小
一般来说小于10kd和大于100kd的蛋白都是难以表达的。
7、外源基因对宿主有毒性
外源基因在宿主内会抑制宿主菌的生长甚至导致宿主死亡,表观的现象:宿主菌在诱导后菌体量上升缓慢或不在生长。
8、基因突变(移筐突变)
碱基的突变、插入或缺失对阅读框的影响,可能会导致表达的蛋白质结构改变,或蛋白质合成过早终止。
9、培养诱导条件
培养基成分(C/N)及培养条件(温度、诱导时机、诱导剂,浓度、诱导时间)也是影响蛋白表达的。
1、 更换宿主菌
稀有密码子补给:BL21 Condon plus (DE3)、Rosetta是为了表达真核蛋白而特别设计的,它含有大肠杆菌稀有的密码子tRNA,包括AUA,AGG,AGA,CUA,CCC和GGA。它们以氯霉素抗性的质粒形式存在。
毒性蛋白:包含pLysS质粒的宿主菌达到稳定期时溶菌酶表达水平较高,而目的蛋白表达水平降低,有效缓解蛋白对宿主带来的影响,也可降低蛋白的表达水平,缓解蛋白对宿主的毒性。
2、 转化菌株进行基因测序
确定基因序列的准确性,查看是否存在突变,截短等。
3、 全菌样品做Western blot
4、 摇TB,小试纯化(选择高温诱导)
5、 更换培养基尝试
有的在LB中不表达,换TB或2*YT则会表达

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved