
 抗体是指能与相应抗原特异结合的具有免疫活性的球蛋白。常规的抗体制备是通过动物免疫并采集抗血清的方法产生的,因而抗血清通常含有针对其他无关抗原的抗体和血清中其他蛋白质成分。一般的抗原分子大多含有多个不同的抗原决定簇,所以常规抗体也是针对多个不同抗原决定簇抗体的混合物。即使是针对同一抗原决定簇的常规血清抗体,仍是由不同B细胞克隆产生的异质的抗体组成。因而,常规血清抗体又称多克隆抗体(polyclonal antibody),简称多抗。
抗体是指能与相应抗原特异结合的具有免疫活性的球蛋白。常规的抗体制备是通过动物免疫并采集抗血清的方法产生的,因而抗血清通常含有针对其他无关抗原的抗体和血清中其他蛋白质成分。一般的抗原分子大多含有多个不同的抗原决定簇,所以常规抗体也是针对多个不同抗原决定簇抗体的混合物。即使是针对同一抗原决定簇的常规血清抗体,仍是由不同B细胞克隆产生的异质的抗体组成。因而,常规血清抗体又称多克隆抗体(polyclonal antibody),简称多抗。
而单克隆抗体(monoclonal antibody)则是由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤(hybridoma)技术来制备——杂交瘤抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的B细胞和具有无限生长能力的骨髓瘤细胞融合为B细胞杂交瘤。这种杂交瘤细胞具有双亲细胞的特征,既像骨髓瘤细胞一样在体外培养中能无限地快速增殖且永生不死,又能像脾淋巴细胞那样合成和分泌特异性抗体。通过克隆化可得到来自单个杂交瘤细胞的单克隆系,即杂交瘤细胞系,它所产生的抗体是针对同一抗原决定簇的高度同质的抗体,即单抗。
与多抗相比,单克隆抗体具有纯度高,专一性强、重复性好、且能持续地无限量供应等优点。单克隆抗体技术的问世,不仅带来了免疫学领域里的一次革命,而且它在生物医学科学的各个领域获得极广泛的应用,促进了众多学科的发展。(单抗与多抗的区别)
抗体是具有4条多肽链的对称结构,形状类似于“Y”的结构,分子量约150kDa。Ig分子的结构包括两个二硫键连接的两半相同的糖蛋白,由两条相同的50kDa的重链(Height Chain)和25kDa的轻链(Light Chain)组成,通过在轻链羧基末端附近的二硫键连接在一起。轻链有κ和λ两种,重链有α、δ、γ、ε和μ五种。
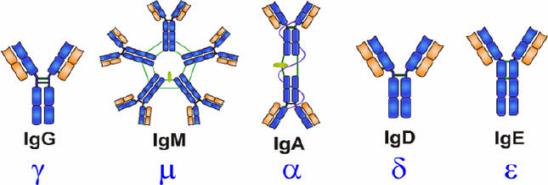
IgDPart of the B cell receptor。Activates basophils and mast cells。
| Name | Properties |
| IgA | Found in mucous,saliva,tears,and breast milk。Protects against pathogens。 |
| IgE | Protects against parasitic worms。Responsible for allergic reactions。 |
| IgG | Secreted by palsma cells in ther blood。Able to cross the placenta into the fetus。 |
| IgM | May be attached to the surface of a B cell or secreted into the blood。Responsible for early stages of immunity |
一个抗体分子上的两个抗原结合部位是相同的,位于两臂末端称抗原结合片段(antigen-binding fragment, Fab)。”Y”的柄部称结晶片段(crystalline fragment, FC),糖结合在FC 上。整个抗体分子可分为恒定区(C区)和可变区(V区)两部分。在给定的物种中,不同抗体分子的恒定区都具有相同的或几乎相同的氨基酸序列。可变区位于“Y”的两臂末端。在可变区内有一小部分氨基酸残基变化特别强烈,这些氨基酸的残基组成和排列顺序更易发生变异区域称高变区(hypervariable region,HVR)。高变区位于分子表面,最多由17个氨基酸残基构成,少则只有2~3个。高变区氨基酸序列决定了该抗体结合抗原抗原的特异性。碳水化合物连接到抗体分子的Fc端,Fc区含有所有的免疫球蛋白共有的蛋白质序列及各个类别独有的决定簇,且在相同类别的不同Ig分子上没有显著变化,所以Fc端称为恒定区。
相关阅读:单克隆抗体基本结构详解
mAb的生物学功能主要是由其结构决定。抗体由抗原结合域(Fab)和结晶区域(Fc)组成,Fab主要特异性识别肿瘤相关抗原,进而调控下游的信号通路。Fc可以识别并结合表达Fc受体的免疫细胞以及血液中的补体进而介导抗体依赖的细胞毒作用(ADCC), 抗体依赖的细胞吞噬作用(ADCP)以及补体依赖的细胞毒作用(CDC)等效应功能,Fc还可以结合新生IgG转运受体(FcRn)从而在体内不被轻易清除而延长了其在机体内的半衰期。在这里根据抗体的结构,我们将其作用机制分为Fab相关的作用机制和Fc相关作用机制。
1)识别游离的靶点
游离于血液循环中的细胞因子、促血管生成因子、生物毒素等都可以作为单抗的作用的靶点。蛋白因子通过与受体的结合,传导信号进入细胞,调控细胞的功能。过量表达的蛋白因子传导过量的信号,打破细胞的正常功能。毒素和病毒等也必须通过与细胞表面的受体结合进入细胞内部从而发挥作用。中和抗体的作用机制就是通过结合抗原进行中和,使抗原丧失结合受体的能力,进而丧失生物学功能。常见的针对游离靶点的抗体有血管内皮生长因子(VEGF)抗体,肿瘤坏死因子(TNF)抗体,炭疽毒素中和抗体等。
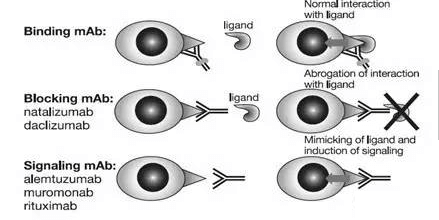 识别细胞表面受体的单克隆抗体的作用机制(Fab dependent)
识别细胞表面受体的单克隆抗体的作用机制(Fab dependent)
每一种抗体都可以特异性结合特定的抗原靶点。靶点抗原表达在细胞表面,具有特定的功能,例如细胞激活、生长或迁移等。根据Fab活性,可以分为结合、拮抗和激活三种类型。结合型抗体只是结合在靶蛋白表面但并不影响其功能。因此,靶蛋白受体的配体仍然可以与其结合,从而传递信号。结合性抗体可以用于标记靶细胞,从而让其Fc产生效应功能或通过搭载毒素来杀灭靶细胞。拮抗性抗体封阻受体上的与配体相互作用所需的表位,阻止配体结合产生的信号传导。激活型抗体能够模拟配体的功能,识别结合靶受体并传导信号至细胞内部。基于被激活的细胞内信号强弱,激活型抗体可能在治疗时使得靶细胞被激活并释放细胞因子,进而产生副作用。
单克隆抗体通过其Fc部位结合各种FcγRs,进而发挥其效应功能,包括ADCC, ADCP和CDC。以最常见的IgG1为例,其Fc区域通过结合FcγRIII(CD16A)激活NK细胞诱导ADCC;与巨噬细胞上FcγRIII(CD16A),FcγRII(CD32A)和FcγRI(CD64)结合,引发ADCP;与补体的C1q结合激活补体引发CDC。Fc还能够以pH依赖的方式结合FcRn,避免被核内体降解,从而延长单克隆抗体的半衰期。
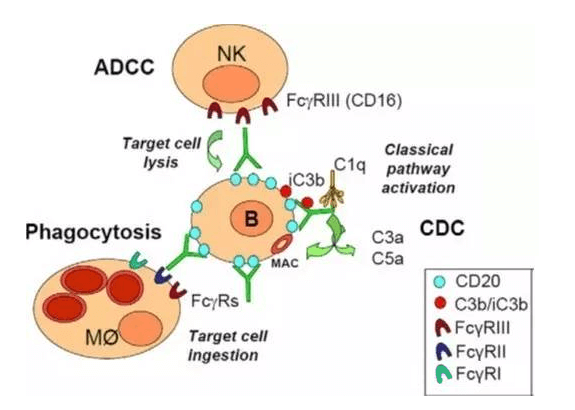 单克隆抗体(IgG1)作用机制(Fc dependent)
单克隆抗体(IgG1)作用机制(Fc dependent)
1)抗体依赖的细胞毒作用(ADCC)
ADCC作用是一种细胞介导的免疫防御机制,在靶细胞膜表面抗原结合了特异性的抗体的情况下,激活免疫系统的效应细胞进而裂解靶细胞的作用。因其对已存在的抗体的依赖性,ADCC作用是适应性免疫反应的一部分,也是体液免疫反应的一部分,用于限制和消除感染。经典的ADCC作用通常由NK细胞介导,但巨噬细胞、中性粒细胞和嗜酸性粒细胞也能介导ADCC作用。比如嗜酸性粒细胞能通过ADCC作用杀死某些特定的寄生虫。
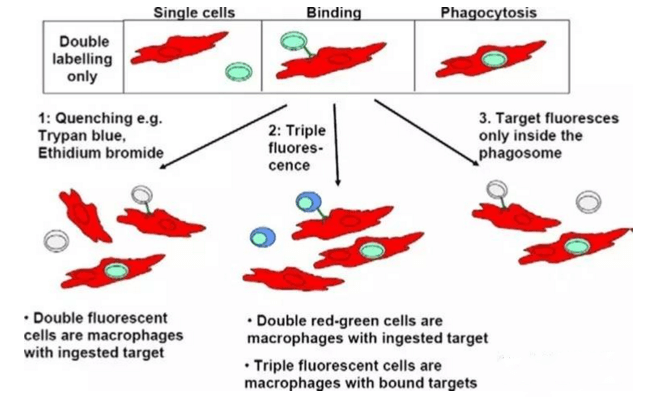
体外检测ADCC效应有几种方法,一种是标记靶细胞的方法:比如用51Cr或具有膜通透性的甲基酯荧光染料,比如calcein-AM或DELFIA-BATDA。靶细胞标记后,加入抗体孵育,然后再加入NK92/CD16A细胞或者从PBMC纯化的NK92,或者PBMC作为效应细胞,不同的效应细胞和靶细胞的比例,不同的孵育时间(通常低于4小时,更长的孵育时间也是可以的,只是自发释放会相应变大)。孵育结束后,加入enhancing solution,用不同的仪器检测放射性同位素和荧光染料,这些方法相对可信但灵敏度不够。其他一些方法,例如检测乳酸脱氢酶(LDH)的释放,这个方法的缺点是由于靶细胞没有被标记,不能区分效应细胞和靶细胞的释放,所以也没有被频繁使用。最有吸引力的检测ADCC效应的方法是基于流式细胞术法(FACS)检测,这种方法通常需要标记靶细胞,或者同时标记靶细胞和效应细胞,然后检测靶细胞的活细胞的减少量,然而这种方法相对比较复杂,因为FACS检测时出现至少两群细胞(包括靶细胞和效应细胞),这需要染双色或者三色。相比较其他,用FACS方法检测ADCC相对可靠,最终结果需要一个独立的方法来验证。无论使用哪种方法,效应细胞通常是PBMC或纯化的NK细胞。效应细胞需要用IL-2预活化过夜以增强效应细胞的活性,但由于个体的差异,以及FcRγIIIA多态性的原因,导致同一个抗体的每次ADCC实验数据差距很大,可重复性差,而使用NK细胞系稳转CD16A,使体外ADCC实验变得更稳定,可重复性强。
2)抗体依赖的细胞吞噬作用(ADCP)
众多小鼠体内实验表明,IgG1的治疗性抗体作用与巨噬细胞及其表达的FcγRs尤其是FcγRIV高度依赖,这些细胞不会引发高效的ADCC效应但是会引发ADCP效应,所以了解ADCP的作用机制也是很有必要的。
测定抗体的ADCP与ADCC类似,都取决于共孵育的两种细胞:适应的靶细胞加入到效应细胞中(巨噬细胞或中性粒细胞),共孵育1-2小时,有时候也需要更长的孵育时间。效应细胞通常是从外周血单核细胞(PBMC)通过免疫亲和方法富集或纯化而来。然后在血清或生长因子例如GM-CSF和/或M-CSF存在下,将它们体外分化4-7天。因此,效应细胞可以广泛变化,不仅是由于供体关联的FcγRs多态性,而且还由于单核细胞来源,纯化程序,分化成巨噬细胞的时间和条件等。
3)补体依赖的细胞毒作用(CDC)
补体是存在于血清与组织液中一组不耐热的,经活化后具有酶活性的蛋白质。抗体的Fc片段能够结合血清补体分子(C1q),继而形成膜攻击复合物(MAC)清除目的细胞。补体的激活过程是个级联过程。首先是识别阶段:抗原与抗体结合后,C1q能识别抗体上的补体结合点,并与之结合。由于C1q的构型发生改变,可激活C1r和C1s;在Ca2存在下,形成具有酶活性的C1s。接着是活化阶段C1s将C4分解成小碎片的C4a和大碎片的C4b,C4b可与细胞膜结合;C1s激活C4后,再激活C2(分解成C2a和C2b);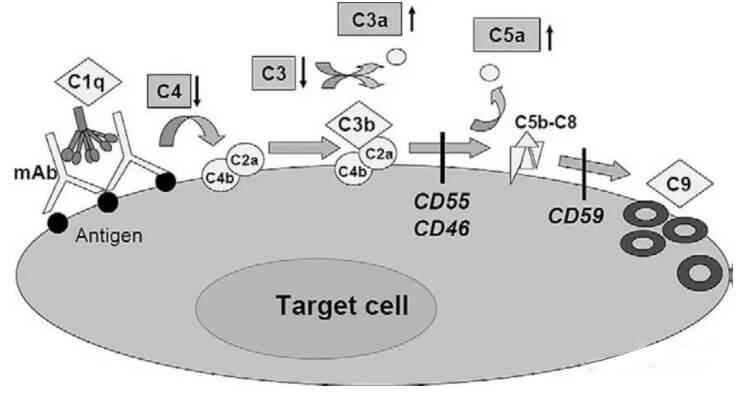 C2b与C4b结合,形成有酶活性的C4b2b(C3转化酶)。C3被C4b2b裂解在C3a和C3b两个片段,C3b与C4b2b相结合产生的C4b2b3b为经典途径的C5转化酶。最后为攻膜阶段C5在C4b2a3b的作用下裂解为C5a和C5b,C5b与细胞膜和C6、C7结合,形成C5b67复合物,进而与C8、C9分子联结成C5b6789复合体,即为攻膜复合体,造成细胞膜溶解。
C2b与C4b结合,形成有酶活性的C4b2b(C3转化酶)。C3被C4b2b裂解在C3a和C3b两个片段,C3b与C4b2b相结合产生的C4b2b3b为经典途径的C5转化酶。最后为攻膜阶段C5在C4b2a3b的作用下裂解为C5a和C5b,C5b与细胞膜和C6、C7结合,形成C5b67复合物,进而与C8、C9分子联结成C5b6789复合体,即为攻膜复合体,造成细胞膜溶解。
虽然许多治疗性抗体恒定区都是人的IgG1的Fc,但它们激活补体的能力却有极大的不同。激活补体不仅需要靶细胞表面表达较高密度的抗原,也需要抗体分子的高特异靶向性,高靶向性才能结合多个C1q并且有效激活补体。另外,位于细胞表面或者一些游离的补体抑制剂能够有效阻断补体级联反应。肿瘤细胞在其细胞表面经常高表达一些补体抑制剂如CD46,CD55和CD59,这些分子能够保护靶细胞免受补体介导的杀伤作用。因此,基于以上这些多因素的存在,导致许多IgG1的抗体只具有非常弱的CD作用。

南京德泰生物工程有限公司 Nanjing Detai Bioengineering Co.,Ltd. ©2025 All Rights Reserved